Molmasa av gas
 Hej! Jag undrar hur man räknar ut momssatser av en okänd gas. Dens temperatur är 273k, densiteten är 0.2g/dm3 och trycket är 0,5kpa. Molvolymen är 24,5dm3/mol. Beräkna molmassan
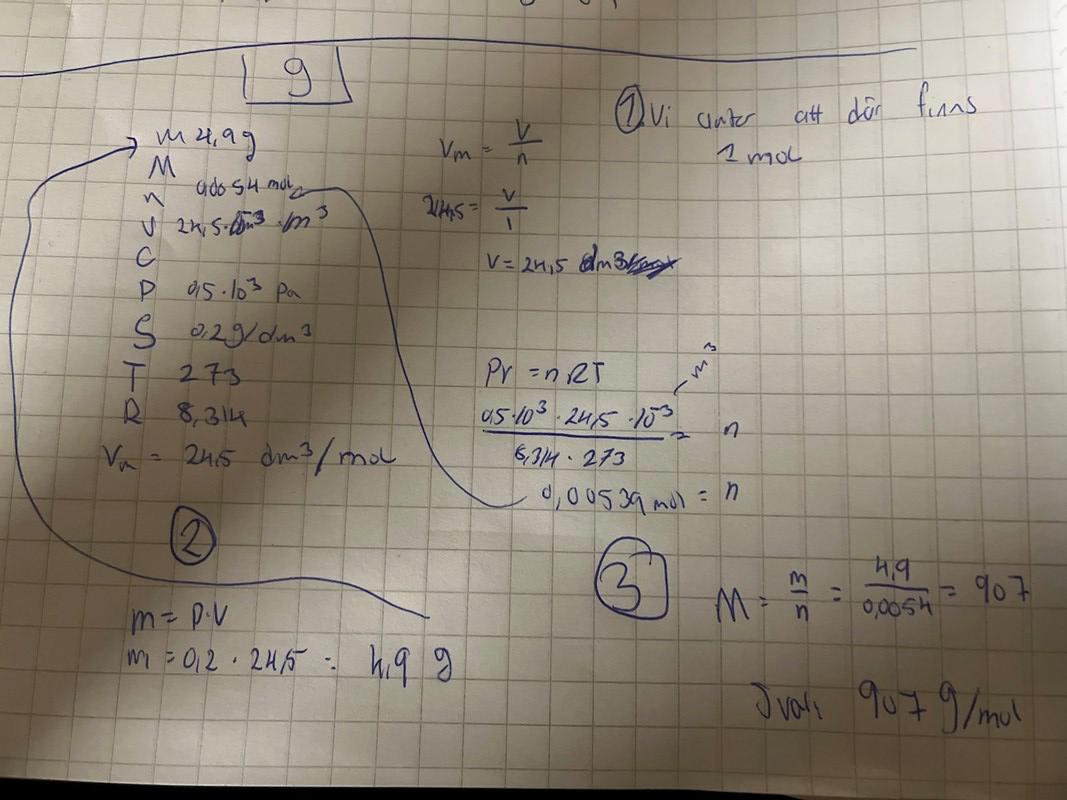
Hej! Jag undrar hur man räknar ut momssatser av en okänd gas. Dens temperatur är 273k, densiteten är 0.2g/dm3 och trycket är 0,5kpa. Molvolymen är 24,5dm3/mol. Beräkna molmassan
har jag gjort rätt? Tack på förhand
Molvolymen brukar vara 22,4 liter vid 0°Coch normalt atmosfärtryck.
Annars får man använda den allmänna gaslagen pV=nRT som du har i din lösning.
Densiteten ger att gasen väger 0,2gdm3=0,210-3kg10-3m3=200 gm3.
500Pa·1m3=200 gx·8,314·273
x=200·8.314·273500≈908 gmol
Svaret är orimligt, med en sådan massa är ämnet fast.
Syret har molmassan 32 gmol och det finns då 1 l22,4 l≈0,04464 mol i 1 dm3 så det ska väga 32·0,04464≈1,43 g under normalt tryck och det blir ca 0,0035 g vid 0,5 kPa.
Har du rätt enheter?
Men här finns ju siffror som du inte alls behöver använda. Du har ju givet att densiteten är 0,2g/dm3 och att molvolymen är 24,5 dm3/mol. Då behöver du bara multiplicera de två värdena med varandra. så får du 4,9 g/mol.
SpKe skrev:så får du 4,9 g/mol.
Vilken gas är det?
Ja, där sa du något MaKe. Rent matematiskt blir det en molvikt på 4,9 g, men det finns ju ingen ren gas som har så låg molvikt. Den enda möjligheten är en blandning av väte och helium i lämpliga proportioner, men det vore fult att kalla det för "en gas". Jag tror att uppgiftskonstruktören har hittat på siffror utan att tänka på att resultatet i princip blir orimligt.
precis så är det! Ville enbart veta hur man ska tänka kring en sådan fråga. Vilken är egentligen rättast? Ska jag enbart utgå från formeln massa=densiteten*volymen? eller ska jag utgå från PV=nRT?
Molvolymen är väl inte samma som volymen, kan jag använda "massa=densitet*volym" och ersätta volym med volym ändå?
Enheten blir g/mol
Frågan handlar ju om molmassan. Det enda sättet att få fram den är att använda molvolymen och inte någon annan volym. Det du vill ta reda på är massan hos en mol av gasen, och då ska du förstås ta exakt 1 mol och inte någon annan mängd.
Jo men nu förstår jag! Tack så hemskt mycket!

