NAD & NADH
Jag har några frågor relaterande till NAD & NADH
1. Tar NAD upp 1 elektron & 1 proton för att bli NADH, eller 2 e & 2 p?
Jag trodde det var den första (1e,1p), då H har 1e, och 1p, men det står annat på nätet
2. Jag ser att det i cellandningens steg kan stå, NADH + H+ ,vad är det?
Maha20 skrev:Jag har några frågor relaterande till NAD & NADH
1. Tar NAD upp 1 elektron & 1 proton för att bli NADH, eller 2 e & 2 p?
Jag trodde det var den första (1e,1p), då H har 1e, och 1p, men det står annat på nätet
NAD+ (notera plustecknet), tar emot en hydridjon H- (d.v.s. en proton med två elektroner).
Atomärt väte H, har endast en elektron och är väldigt reaktiv. För att skapa atomärt väte behöver bindningselektronerna, t.ex. mellan C-H delas lika, vilket leder till två radikaler (både C och H får varsin oparad elektron) - och det sker inte.
Det går att flytta enstaka elektroner, med till det använder cellerna FAD+/FADH/FADH2, eller andra kofaktorer som järnsvavelkluster.
2. Jag ser att det i cellandningens steg kan stå, NADH + H+ ,vad är det?
Vad tror du det kan vara? NAHD har du redan frågat om, så den borde du känna igen.
Samma sak med H+, den är bekant från syra/basavsnittet i Ke1.
Tack för hjälpen!
Jag förstår tyvärr inte det andra stycket med atomärt väte.
Jag hittade detta på nätet:
NAD+ accepts two elections and one proton. So the substrate will loose two hydrogen atoms. Two hydrogen atoms have two electrons and two protons. Since NAD+ can only take two electrons and one proton (in other words a hydride, H-), a proton is always produced as a byproduct.
2H - - > 2e- + 2H+
2H - - > H- + H+
These two reactions are same. So NAD+ accepts H- and H+ is always a byproduct.
Jag antar det som NAD tar upp 2 väteatomer från det som oxideras, men NAD gör H+:et som en biprodukt? (lite konstigt formulerat)
Är även osäker på vad H+ & H- är i detta:
2H - - > 2e- + 2H+
2H - - > H- + H+
Varför skriver man inte e resp p, utan H+ & H-? Jag vet att ex H+ består av 1 p, men det är väl en jon? Delas väte in i joner?
Tillägg: 29 feb 2024 21:19
(Frågan ligger ej under kemi 2, utan universitet)
Maha20 skrev:Tack för hjälpen!
Jag förstår tyvärr inte det andra stycket med atomärt väte.
Jag hittade detta på nätet:
NAD+ accepts two elections and one proton. So the substrate will loose two hydrogen atoms. Two hydrogen atoms have two electrons and two protons. Since NAD+ can only take two electrons and one proton (in other words a hydride, H-), a proton is always produced as a byproduct.
Nettomässigt motsvarar det två väteatomer, men väteatomer förekommer inte av sig själva (de är för reaktiva och skulle bilda vätgas H2, vilket inte är så mysigt i kroppen, och inte heller så effektivt då vi inte kan använda denna gas.
Det som överförs från substratet är en hydridjon, när substratet oxideras. Och samtidigt reduceras NAD+ till NADH, med hjälp hydridjonen.
Det som sker är att bindningen mellan t.ex. C-H bryts, och båda bindningselektronerna skapar en ny bindning till NAD+. I samband med detta accepterar C ett annat elektronpar, ofta från en hydroxigrupp, så att C har en full oktett. En enkelbindning försvinner, men ett nytt elektronpar används för att bilda en dubbelbindning istället.
Och när hydroxigruppen skapat dubbelbindningen med ett av syrets fria elektronpar, blir syret elektronfattigt (det binder till C med en dubbelbindning, har ett fritt elektronpar kvar och en enkelbindning till vätet), med laddningen plus ett. Och när bindningen mellan O-H bryts, behåller syret båda bindningselektronerna, och blir då en oladdad karbonylgrupp (C=O). Denna proton frisätts precis som när en syra protolyseras, men då laddningen var plus ett, blir laddningen neutral (+1 -1=0).
Ta en titt på en reaktionsmekanism från t.ex. TCA så ser du nog visuellt vad som sker.
2H - - > 2e- + 2H+
2H - - > H- + H+
These two reactions are same. So NAD+ accepts H- and H+ is always a byproduct.
Jag antar det som NAD tar upp 2 väteatomer från det som oxideras, men NAD gör H+:et som en biprodukt? (lite konstigt formulerat)
Är även osäker på vad H+ & H- är i detta:
2H - - > 2e- + 2H+
2H - - > H- + H+
Varför skriver man inte e resp p, utan H+ & H-? Jag vet att ex H+ består av 1 p, men det är väl en jon? Delas väte in i joner?
Jo väte delas in i joner, och det är jonerna som förekommer inom biokemin (under gymnasiet, det finns mer exotiska reaktioner med atomärt väte, men det är bortanför biokemin som vanligtvis lärs ut på universitetsnivå).
Protonen kallas för just det, eller visas som H+. Hydridjonen är den som rent kemiskt förekommer vid dessa reaktioner. Det är m.a.o. aldrig tal om att enstaka elektroner hoppar, eller att två protoner sedan flyttar, eller liknande.
Jag förstår delvis. Jag ska försöka fylla in mina kunskapsluckor först innan jag svarar ordentligt. Tack än så länge!
Jo väte delas in i joner, och det är jonerna som förekommer inom biokemin (under gymnasiet, det finns mer exotiska reaktioner med atomärt väte, men det är bortanför biokemin som vanligtvis lärs ut på universitetsnivå).
Protonen kallas för just det, eller visas som H+. Hydridjonen är den som rent kemiskt förekommer vid dessa reaktioner. Det är m.a.o. aldrig tal om att enstaka elektroner hoppar, eller att två protoner sedan flyttar, eller liknande.
Så det är inte så att två H hos substratet sammanlagt skickar 2 elektroner & 1 proton, utan de måste vara bundna till något, en jon? När jag tänker oxidation, tänker att att elektroner hoppas över till ett annat ämne, som så:
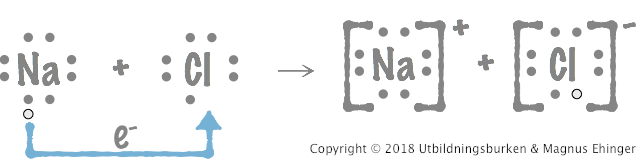
Jag skrev en liknande fråga gällande H+ i en annan tråd om syrabasreaktioner, men det gäller fortfarande här. Jag känner inte att jag fick svar på frågan:
Jag tror du missförstod min fråga. Jag menar mer att jag inte förstår varför man säger att en proton är en vätejon. En vätejon är ju ett väte med 1 proton. Alltså är inte vätejon = proton.
Det är inga problem med att ta emot/skicka iväg elektroner så som de är, de är ju inte bundna till något (?). När man säger att något avger elektroner, syftar man ju inte på att elektroner avges i form av joner.
Men när man pratar om protoner, och att det ska ex avges, måste det vara i form av en vätejon, alltså protonerna måste vara bundna till något, och inte bara protoner i sig?
Vet inte om detta är korrekt. Misstänker att det har något med kärnreaktioner som du nämnde. Men kan ej dra kopplingen.
Summan av kardemumman, varför avges protoner i form av joner, och varför säger man bara 'elektroner' när man syftar på att de avges/tas emot, och inte det i form av joner som protoner
Maha20 skrev:Jo väte delas in i joner, och det är jonerna som förekommer inom biokemin (under gymnasiet, det finns mer exotiska reaktioner med atomärt väte, men det är bortanför biokemin som vanligtvis lärs ut på universitetsnivå).
Protonen kallas för just det, eller visas som H+. Hydridjonen är den som rent kemiskt förekommer vid dessa reaktioner. Det är m.a.o. aldrig tal om att enstaka elektroner hoppar, eller att två protoner sedan flyttar, eller liknande.
Så det är inte så att två H hos substratet sammanlagt skickar 2 elektroner & 1 proton, utan de måste vara bundna till något, en jon?
Ja alla är bundna till något, även protonen är bunden till en vattenmolekyl - det som i allmänhet kallas proton H+ finns i vattenlösningar bundet till just en vattenmolekyl, och finns i form av en hydroniumjon H3O+.
Vid de biokemiska reaktioner som sker bl.a. i cellen, sitter en proton bundet med en enkelbindning till ett annat ämne. Och denna proton och bägge bindningselektronerna kan överföras till NAD+.
När jag tänker oxidation, tänker att att elektroner hoppas över till ett annat ämne, som så:
Ja det är precis vad som sker, elektronerna "hoppar över" till NAD+, tillsammans med en proton. Lite överkurs kanske, men en av anledningarna till att protonen följer med är att om NAD+ bara tar upp två elektroner så hamnar de på en kolatom, som då blir en karboanjon. Och denna jon är väldigt reaktiv, och kommer försöka skapa en ny bindning till ett annat ämne, gärna ett elektronfattigt/positivt - precis som en proton.
Jag skrev en liknande fråga gällande H+ i en annan tråd om syrabasreaktioner, men det gäller fortfarande här. Jag känner inte att jag fick svar på frågan:
Jag tror du missförstod min fråga. Jag menar mer att jag inte förstår varför man säger att en proton är en vätejon. En vätejon är ju ett väte med 1 proton. Alltså är inte vätejon = proton.
Det är inga problem med att ta emot/skicka iväg elektroner så som de är, de är ju inte bundna till något (?). När man säger att något avger elektroner, syftar man ju inte på att elektroner avges i form av joner.
Men när man pratar om protoner, och att det ska ex avges, måste det vara i form av en vätejon, alltså protonerna måste vara bundna till något, och inte bara protoner i sig?
Vet inte om detta är korrekt. Misstänker att det har något med kärnreaktioner som du nämnde. Men kan ej dra kopplingen.
Summan av kardemumman, varför avges protoner i form av joner, och varför säger man bara 'elektroner' när man syftar på att de avges/tas emot, och inte det i form av joner som protoner
Ja alla är bundna till något, även protonen är bunden till en vattenmolekyl - det som i allmänhet kallas proton H+ finns i vattenlösningar bundet till just en vattenmolekyl, och finns i form av en hydroniumjon H3O+.
Vid de biokemiska reaktioner som sker bl.a. i cellen, sitter en proton bundet med en enkelbindning till ett annat ämne. Och denna proton och bägge bindningselektronerna kan överföras till NAD+.
1. Jag menade mer här att när elektroner flyttas, förflyttas de inte med en atom/jon. Elektronerna är bunden till ett annat ämne, men den liksom förflyttas inte med något annat. Så som på bilden. Protonen förflyttas däremot i form av en vätejon. Men jag vet inte om det är missvisande att kalla just protonen för vätejon. Vätejonen bär ju på protonen.
Tror därför jag inte riktigt hänger med i det sista stycket du skrev.
2.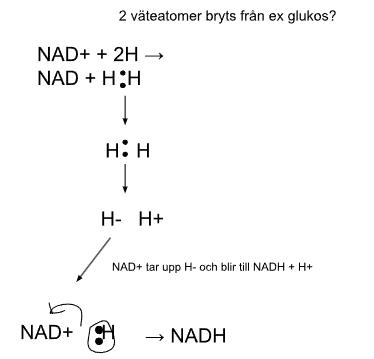
(på det 3:e steget menar jag att H:et till vänster tar elektronen från det högra H:et till sig själv)
Jag skrev detta, mycket slarvigt men ja. Är detta så NAD+ reduceras till NADH - i enkel version?
I sista steget har jag svårt att se hur H:ets elektroner ''hoppar över'' till NAD+ skal (?) & sen hur NAD & H:et binds ihop sen (så att NADH bildas). Hänger en proton med när detta H binder till NAD+?
Tillägg: 9 mar 2024 14:53
Jag kom på att ''Jag menade mer här att när elektroner flyttas, förflyttas de inte med en atom/jon'' syftade jag på bilden NA, CI. Men när det gäller glukos, förflyttas väte & dess elektroner. Så då förflyttas elektronerna med en något.
Jag tror det blir lättare för dig att se helheten om du tittar på en beskrivning för hur denna reaktion sker i ett enzym - det faktiska sammanhanget där denna typ av red/ox reaktioner sker.
Som jag skrev tidigare, finns det (t.o.m. flera) enzymer inom citronsyracykeln som bildar NADH - och det kan vara en bra utgångspunkt. Det blir lättare, och mer relevant att titta på hur reaktionen sker, än att själv försöka sammanfatta hur man tror att endast ett av substraten kan reagera helt själv.
Finns det inte beskrivet i kemiboken, finns det ganska bra beskrivningar på Engelska versionen av Wikipedia för samtliga enzymer inom citronsyracykeln, där även reaktionsmekanismerna finns illustrerade.
Och igen, det är aldrig några väteatomer som är inblandade - det är alltid joner av grundämnet väte som reagerar (det är en ganska stor skillnad mellan dem).

