Natriumvätekarbonat
Hej jag behöver hjälp med uppgiften nedan och vet inte hur ska jag lösa det.
Natriumvätekarbonat, NaHCO3, sönderdelas när det upphettas. Det kan tänkas ske
på tre olika sätt. Reaktionsformlerna nedan visar vilka tre sätt det är frågan om
1. NaHCO3 (s) ----> NaOH (s) + CO2
2. NaHCO3 (s) ----> Na2O (s) + H2O (g) + 2 CO2 (g)
3. NaHCO3 (s) ----> Na2CO3 (s) + H2O (g) + CO2 (g)
Genom att väga natriumvätekarbonat vilket har blivit, sedan upphetta och därefter väga
reaktionsprodukten vilket har blivit, kan man räkna ut vilken av reaktionsformlerna som
beskriver sönderdelningen.
Massa NaHCO3 före upphettning: 2,13g
Massa efter upphettning: 1,35g
hur ska jag börja nu?
Ta reda på hur många mol NaHCO3 du hade från början.
Titta på de tre reaktionsformlerna och fundera ut hur många mol fast återstod det bildas i vart och ett av fallen, och räkna ut vilken massa denna återstod skulle ha. Jämför med den uppvägda massan.
Smaragdalena skrev:Ta reda på hur många mol NaHCO3 du hade från början.
Titta på de tre reaktionsformlerna och fundera ut hur många mol fast återstod det bildas i vart och ett av fallen, och räkna ut vilken massa denna återstod skulle ha. Jämför med den uppvägda massan.
 så här långt har jag kommit. hur ska jag göra nu?
så här långt har jag kommit. hur ska jag göra nu?
visst ska jag nu räkna ut massan? vilket blir
m= n . M ?
och om ja så vet jag inte vad n(substansmägnden) är? är det min mägnd av natriumvätekarbonat? och om ja igen, så är det frågan om den mägnden före eller efter upphättning? vilket blir 1,35g efter eller 2,13g före
tacksam för hjälp :)
Det du hade före upphettningen var 2,13 g NaHCO3. Hur många mol var det?
Det du har efter upphettningen är 1,35 g av något ämne, du vet inte riktigt vilket, men du tror att det antingen är NaOH, Na2O eller Na2CO3.
Om det är NaOH, hur många mol är det (titta på reaktionsformeln)? Vilken massa borde det ha? Stämmer det med att massan är 1,35 g?
Om det är Na2O, hur många mol är det (titta på reaktionsformeln)? Vilken massa borde det ha? Stämmer det med att massan är 1,35 g?
Om det är Na2CO3, hur många mol är det (titta på reaktionsformeln)? Vilken massa borde det ha? Stämmer det med att massan är 1,35 g?
Smaragdalena skrev:Det du hade före upphettningen var 2,13 g NaHCO3. Hur många mol var det?
Det du har efter upphettningen är 1,35 g av något ämne, du vet inte riktigt vilket, men du tror att det antingen är NaOH, Na2O eller Na2CO3.
Om det är NaOH, hur många mol är det (titta på reaktionsformeln)? Vilken massa borde det ha? Stämmer det med att massan är 1,35 g?
Om det är Na2O, hur många mol är det (titta på reaktionsformeln)? Vilken massa borde det ha? Stämmer det med att massan är 1,35 g?
Om det är Na2CO3, hur många mol är det (titta på reaktionsformeln)? Vilken massa borde det ha? Stämmer det med att massan är 1,35 g?
Jag vet att Natriumvätekarbonat har 84g/mol. Men vet inte hur ska jag veta hur många mol 2,13g Natriumvätekarbonat har hur ska jag få veta det?
är det: n = m/M ----> n= 84,79/2,13= 0,025 mol
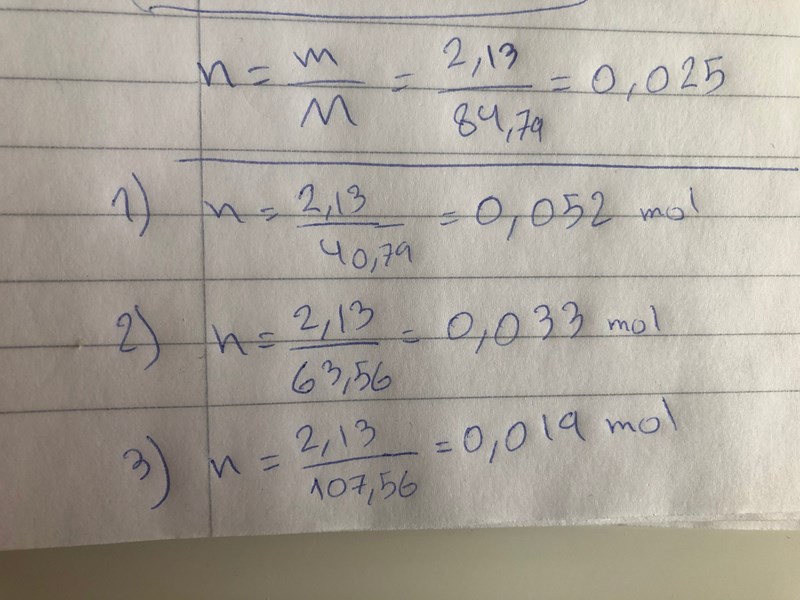
Du har vänt på siffrorna (det skall vara 2,13/84,79), men verkar ha räknat rätt i alla fall.
Rahim skrev:Smaragdalena skrev:Det du hade före upphettningen var 2,13 g NaHCO3. Hur många mol var det?
Det du har efter upphettningen är 1,35 g av något ämne, du vet inte riktigt vilket, men du tror att det antingen är NaOH, Na2O eller Na2CO3.
Om det är NaOH, hur många mol är det (titta på reaktionsformeln)? Vilken massa borde det ha? Stämmer det med att massan är 1,35 g?
Om det är Na2O, hur många mol är det (titta på reaktionsformeln)? Vilken massa borde det ha? Stämmer det med att massan är 1,35 g?
Om det är Na2CO3, hur många mol är det (titta på reaktionsformeln)? Vilken massa borde det ha? Stämmer det med att massan är 1,35 g?
Jag vet att Natriumvätekarbonat har 84g/mol. Men vet inte hur ska jag veta hur många mol 2,13g Natriumvätekarbonat har hur ska jag få veta det?
är det: n = m/M ----> n= 84,79/2,13= 0,025 mol
är det då den tredje ämne vilket är Na2CO3(s) som heter Natriumkarbonat?
det blir detta ämne efter upphettningen?
Smaragdalena skrev:Du har vänt på siffrorna (det skall vara 2,13/84,79), men verkar ha räknat rätt i alla fall.
Ja, på räkningen så insåg jag att det var n=m/M
men blev det rätt? ska nu gämföra siffrorna med det som jag har fått?
eller vad ska jag göra nästa?
ska jag nu räkna vad massan blir av alla tre ämnena?
m=n . M
Oj, nu ser jag att de båda nedre av dina reaktionsformler inte är balanserade. Du måste ha korrekta reaktionsformler om du skall kunna läsa uppgiften. Det som fattas är en tvåa framför NaHCO3 i båda formlerna.
Smaragdalena skrev:Oj, nu ser jag att de båda nedre av dina reaktionsformler inte är balanserade. Du måste ha korrekta reaktionsformler om du skall kunna läsa uppgiften. Det som fattas är en tvåa framför NaHCO3 i båda formlerna.
ja Juste jag sjäv tog bort den av ett misstag. Här kommer den med balanserade reaktion
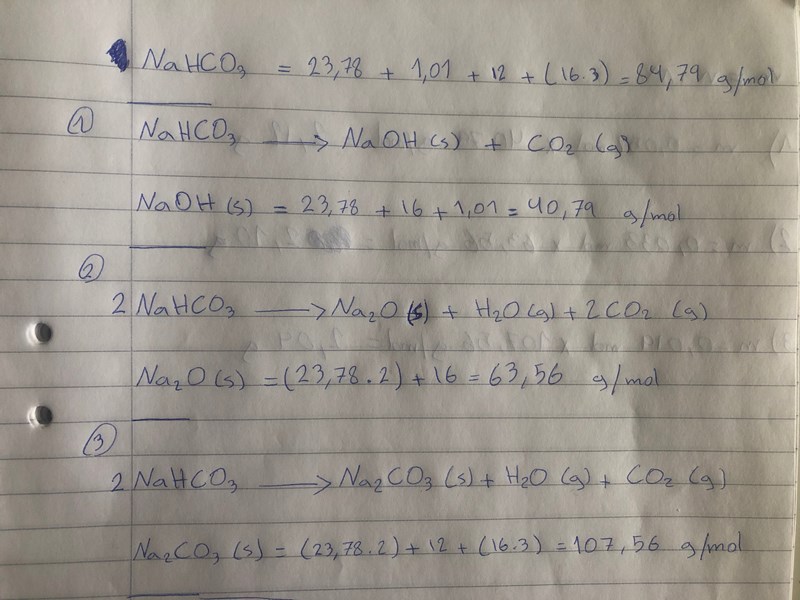
Av den första reaktionsformeln kan man se att 1 mol NaHCO3 ger 1 mol NaOH. 0,025 mol NaHCO3 ger alltså 0,025 mol NaOH. Vilken blir massan?
Av den andra reaktionsformeln kan man se att 2 mol NaHCO3 ger 1 mol Na2O. 0,025 mol NaHCO3 ger alltså 0,0125 mol Na2O. Vilken blir massan?
Av den tredje reaktionsformeln kan man se att 2 mol NaHCO3 ger 1 mol Na2CO3. 0,025 mol NaHCO3 ger alltså 0,025 mol Na2CO3. Vilken blir massan?
Vilken av massorna stämmer bäst med den uppvägda massan?
Rahim skrev:Smaragdalena skrev:Du har vänt på siffrorna (det skall vara 2,13/84,79), men verkar ha räknat rätt i alla fall.
Ja, på räkningen så insåg jag att det var n=m/M
men blev det rätt? ska nu gämföra siffrorna med det som jag har fått?
eller vad ska jag göra nästa?
ska jag nu räkna vad massan blir av alla tre ämnena?
m=n . M
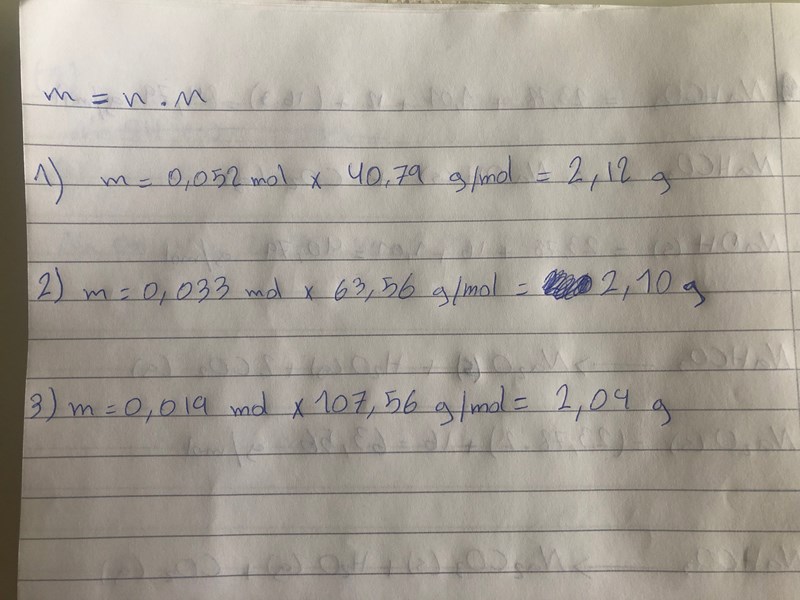
Smaragdalena skrev:Av den första reaktionsformeln kan man se att 1 mol NaHCO3 ger 1 mol NaOH. 0,025 mol NaHCO3 ger alltså 0,025 mol NaOH. Vilken blir massan?
Av den andra reaktionsformeln kan man se att 2 mol NaHCO3 ger 1 mol Na2O. 0,025 mol NaHCO3 ger alltså 0,0125 mol Na2O. Vilken blir massan?
Av den tredje reaktionsformeln kan man se att 2 mol NaHCO3 ger 1 mol Na2CO3. 0,025 mol NaHCO3 ger alltså 0,025 mol Na2CO3. Vilken blir massan?
Vilken av massorna stämmer bäst med den uppvägda massan?
det ser ut som att den tredje passar bäst och är närmast till 1,35g
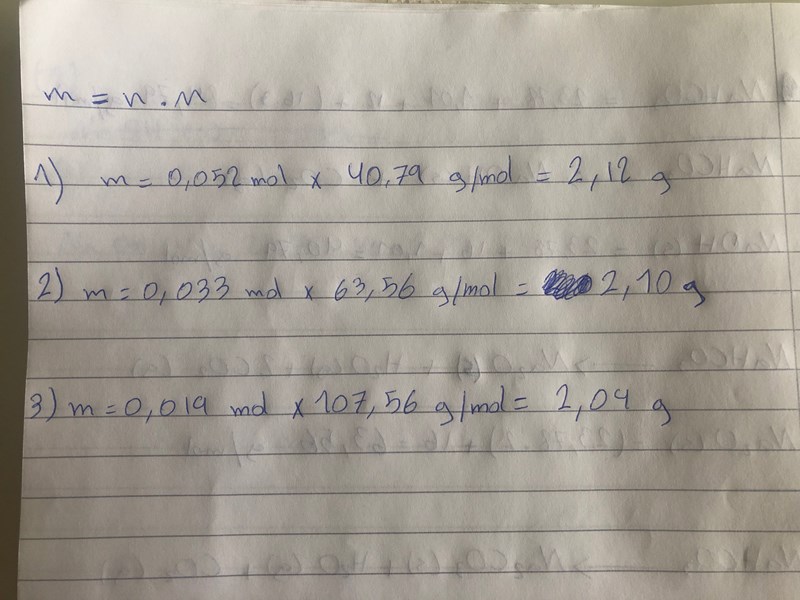
Jag förstår inte alls vad det är du gr p den här bilden Varifrån får du siffrorna 0,052 respektive 0,033 respektive 0,019?
Smaragdalena skrev:Jag förstår inte alls vad det är du gr p den här bilden Varifrån får du siffrorna 0,052 respektive 0,033 respektive 0,019?
Här kommer det ifrån. Jag räknade substansmägnden på alla tre reaktionsformler.
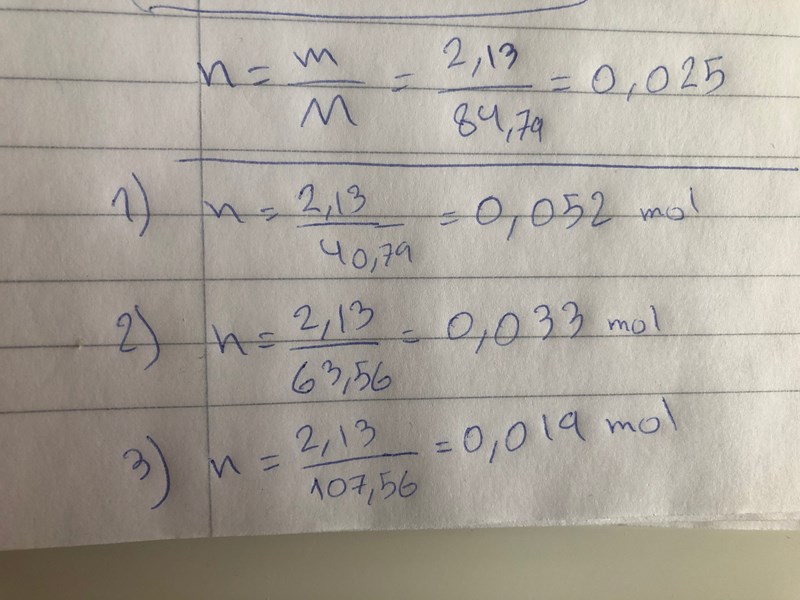
Smaragdalena skrev:Av den första reaktionsformeln kan man se att 1 mol NaHCO3 ger 1 mol NaOH. 0,025 mol NaHCO3 ger alltså 0,025 mol NaOH. Vilken blir massan?
Av den andra reaktionsformeln kan man se att 2 mol NaHCO3 ger 1 mol Na2O. 0,025 mol NaHCO3 ger alltså 0,0125 mol Na2O. Vilken blir massan?
Av den tredje reaktionsformeln kan man se att 2 mol NaHCO3 ger 1 mol Na2CO3. 0,025 mol NaHCO3 ger alltså 0,025 mol Na2CO3. Vilken blir massan?
Vilken av massorna stämmer bäst med den uppvägda massan?
på den andra reaktions formler är du säker att det är 0,0125 och inte är 0,025?
och om det är 0,0125 så blir det så som jag har räknat. den som är närmast 1.35 g är reaktionsformeln tre Natriumkarbonat Na2CO3 (s)??
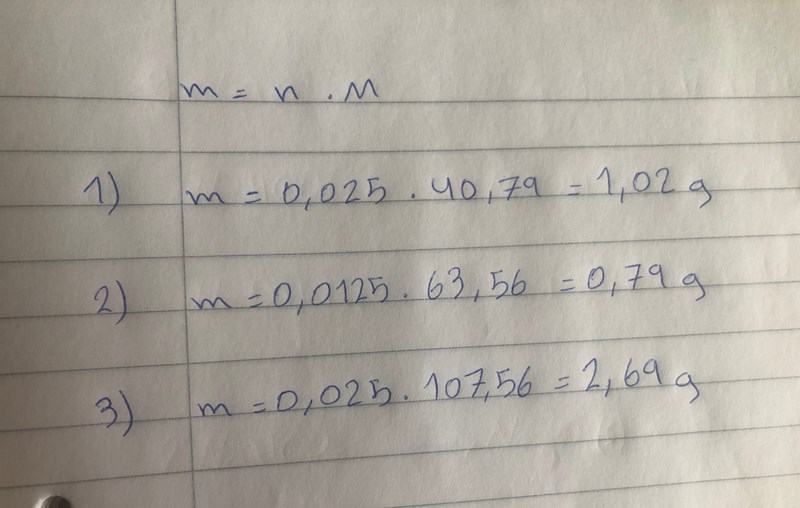
Du måsta ta hänsyn till att det bara bildas hälften så många mol natriumoxid och natriumkarbonat jämfört med substansmängen natriumvätekarbonat från början, och så får du jämför med de teoretiska substansmängderna.
Smaragdalena skrev:Du måsta ta hänsyn till att det bara bildas hälften så många mol natriumoxid och natriumkarbonat jämfört med substansmängen natriumvätekarbonat från början, och så får du jämför med de teoretiska substansmängderna.
kan du kolla den förra kommentaren jag har ändrat lite? och om det är rätt?
Ändra inte i gamla inlägg - tråden blir helt obegriplig då. Gör ett nytt inlägg istället.
Smaragdalena skrev:Ändra inte i gamla inlägg - tråden blir helt obegriplig då. Gör ett nytt inlägg istället.
förstår det. Jag sa att är du säker att på andra reaktionsformlen blir 0,0125 och inte 0,025? för det är ganska mycket skillnad. och om det är 0,0125 så blir det som jag har skrivit och du ser nedan på bilden.
och att den närmaste reaktionen till 1,35g blir den första reaktinen ???
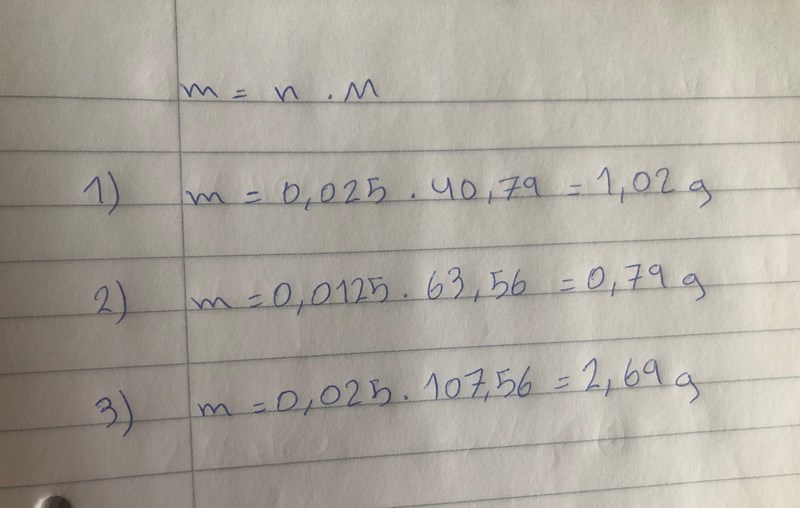
Smaragdalena skrev:Av den första reaktionsformeln kan man se att 1 mol NaHCO3 ger 1 mol NaOH. 0,025 mol NaHCO3 ger alltså 0,025 mol NaOH. Vilken blir massan?
Av den andra reaktionsformeln kan man se att 2 mol NaHCO3 ger 1 mol Na2O. 0,025 mol NaHCO3 ger alltså 0,0125 mol Na2O. Vilken blir massan?
Av den tredje reaktionsformeln kan man se att 2 mol NaHCO3 ger 1 mol Na2CO3. 0,025 mol NaHCO3 ger alltså 0,025 0,0125 mol Na2CO3. Vilken blir massan?
Vilken av massorna stämmer bäst med den uppvägda massan?
Jag ser att att jag har missat en siffra i avsnittet om den tredje reaktionsformeln. Det skall bildas 0,0125 mol Na2CO3 - det år ju två natriumjoner i varje formelenhet, så det kan bara bli hälften så många mol.
Smaragdalena skrev:Smaragdalena skrev:Av den första reaktionsformeln kan man se att 1 mol NaHCO3 ger 1 mol NaOH. 0,025 mol NaHCO3 ger alltså 0,025 mol NaOH. Vilken blir massan?
Av den andra reaktionsformeln kan man se att 2 mol NaHCO3 ger 1 mol Na2O. 0,025 mol NaHCO3 ger alltså 0,0125 mol Na2O. Vilken blir massan?
Av den tredje reaktionsformeln kan man se att 2 mol NaHCO3 ger 1 mol Na2CO3. 0,025 mol NaHCO3 ger alltså 0,025 0,0125 mol Na2CO3. Vilken blir massan?
Vilken av massorna stämmer bäst med den uppvägda massan?
Jag ser att att jag har missat en siffra i avsnittet om den tredje reaktionsformeln. Det skall bildas 0,0125 mol Na2CO3 - det år ju två natriumjoner i varje formelenhet, så det kan bara bli hälften så många mol.
då blir det naturlogtvis den tredje som är närmast efter upphettningen?
så reaktionsformlen som blir efter uphettningen är NaHCO3(s) Natriumkarbonat (s)
visst?
Ja, det bildas natriumkarbonat (även kallat soda).
Smaragdalena skrev:Ja, det bildas natriumkarbonat (även kallat soda).
Tack så mycket för hjälpen.


