Neutralisation mellan H3PO4 och NaOH
Hej!
Antag att jag har en lösning av fosforsyra H3PO4 med obestämd koncentration. Jag tillsätter NaOH till lösningen, fram tills pH = 5. Min fråga är, efter man gjort detta, vilka ämnen finns i lösningen?
Jag vet att följande reaktioner är relevata:
- NaOH → Na+ + OH–
- H3PO4 → H2PO4– + H3O+
- OH– + H3O+ → 2 H2O
- Na+ + H2PO4– → NaH2PO4
Dessutom, vid jämvikt när pH = 5 gäller det att [H3O+] = 10–5. Och [OH–] = 10–9.
När jag frågade en annan fråga angående samma problem på pluggakuten, fick jag svaret att lösningen nästan enbart kommer bestå av natriumdivätefosfat samt inga andra former av fosfat. Men hur resonerar man sig fram till detta svar?
Börja med att ta reda på pKa-värdena för fosforsyra, divätefosfatjon och vätefosfatjon.
Smaragdalena skrev:Börja med att ta reda på pKa-värdena för fosforsyra, divätefosfatjon och vätefosfatjon.
Ok,
Fosforsyra: pKa = 2,15
Divätefosfatjon: pKa = 7,21
Vätefosfatjon: pKa = 12,36
Jag vet att pKa = –lgKa men jag vet inte vad man har för nytta av att veta pKa-värdena.
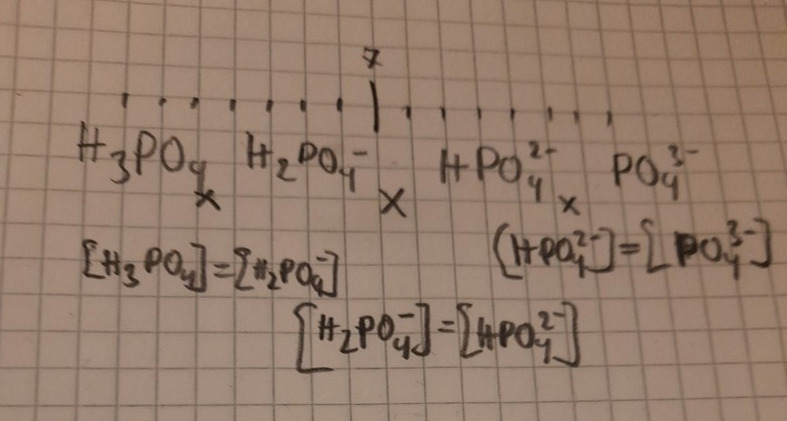
Här är en pH-skala med de tre pKa-värdena markerade. Nedanför vart och ett av de värdena har jag skrivit vilka koner som har samma koncentration. Ocvanför har jag skrivit vilken partikel som har högst koncentration i vart och ett av intervallen. När pH är en enhet större än pKa är koncentrationen av basformen 10 ggr så stor som syraformen, så vid pH = 3,15 finns det 10 ggr så mycket divätefosfatjoner som fosforsyrajoner. På liknande sätt finns det 10 ggr så mycket divätefosfatjoner som vätefosfatjoner nä rpH = 6,21. Mellan dessa värden är dominansen för divätefosfatjoner ännu större.
Smaragdalena skrev:
Här är en pH-skala med de tre pKa-värdena markerade. Nedanför vart och ett av de värdena har jag skrivit vilka koner som har samma koncentration. Ocvanför har jag skrivit vilken partikel som har högst koncentration i vart och ett av intervallen. När pH är en enhet större än pKa är koncentrationen av basformen 10 ggr så stor som syraformen, så vid pH = 3,15 finns det 10 ggr så mycket divätefosfatjoner som fosforsyrajoner. På liknande sätt finns det 10 ggr så mycket divätefosfatjoner som vätefosfatjoner nä rpH = 6,21. Mellan dessa värden är dominansen för divätefosfatjoner ännu större.
Jag fattar!
Nu vet jag varför divätefosfatjoner är dominerande.
Men jag vet inte varför detta tar sig uttryck genom natriumdivätefosfat. Hur vet man att det finns tillräckligt många natriumjoner för att skapa jonföreningar så att det inte blir några divätefosfatjoner över?
Du har tillsatt NaOH tills pH blev 5, då finns det tillräckligt mycket natriumjoner (annars hade inte pH kunnat bli 5). Du har ju tillsatt en substansmänngd NaOH som är större än halva substansmängden för fosforsyra (då skulle pH ha varit lika med pKa1, d v s 2,15), men mindre än 1,5 gånger substansmängden för fosforsyra (då skulle pH ha varit lika med pKa2, d v s 7,21).
Tack!
Har funderat lite på det här nu.
Har jag rätt i att det till slut kommer finnas ett överskott av natriumjoner som är fria i lösningen?
Stenenbert skrev:Har funderat lite på det här nu.
Har jag rätt i att det till slut kommer finnas ett överskott av natriumjoner som är fria i lösningen?
Vad menar du med "till slut"? Ju mer natriumjoner du tillsätter, desto fler natriumjoner finns det... Natriumjonerna är omgivna av vattenmolekyler (jon-dipolbindning).
Smaragdalena skrev:Stenenbert skrev:Har funderat lite på det här nu.
Har jag rätt i att det till slut kommer finnas ett överskott av natriumjoner som är fria i lösningen?
Vad menar du med "till slut"? Ju mer natriumjoner du tillsätter, desto fler natriumjoner finns det... Natriumjonerna är omgivna av vattenmolekyler (jon-dipolbindning).
Ledsen, dålig formulering.
Med "till slut" menar jag när pH har höjts till 5. Det kommer ju finnas divätefosfatjoner, vätefosfatjoner och fosfatjoner i lösningen. Natriumjonerna kommer binda till dessa, och min fråga är om det kommer bli några natriumjoner över efteråt.
Vad menar du med att "natriumjonerna kommer att binda till dessa"? Oxoniumjonerna, natriumjonerna, divätefosfatjonerna och vätefosfatjonerna kommer att vara lösta i vattnet(det kommer knappt att finnas några fosforsyramolekyler, fosfatjoner eller hydroxidjonervid det pH-värdet).
Vad menar du med "bli över"? Det kommer att finnas lagom många natriumjoner för att lösningen skall vara oladdad.
Tror jag fattar nu. Sorry att det var oklart, jag tror inte jag själv var riktigt säker på vad min fråga var.