Noder - orbitaler och när en radial wavefunction når noll
"Although an electron in an s-orbital may be found at the nucleus and electron in any other type of orbital will not be found there."
Just innan detta har man pratat om noder och att tex 2p inte har en nod. Är noder och att inte elektronen i orbitalen kan hittas vid kärnan skilda saker?
Vad är skillnaden mellan nod och att "the radial wavefunktion" når noll?
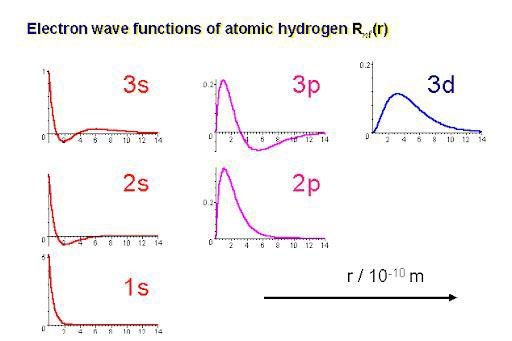
Jag förstår inte vad du skriver. En p-orbital har ett nodplan tvärs igenom kärnan. Det är bara s-orbitaler som inte har något nodplan. Som du ser har vågfunktionen för s-orbitalerna ett värde skilt från 0 när r = 0, men vågfunktionerna för p- och d-orbitalerna har värdet 0 när r = 0.
Jag formulerar om min fråga:
"Although an electron in an s-orbital may be found at the nucleus and electron in any other type of orbital will not be found there."
1) Varför kan man inte hitta någon annan elektron där?
-----------------
Frågor för att förstå ovan:
2) Men är inte en nod att vågfunktionen passerar genom nollstrecket?
3) 2s och 3s har väl noder?
4) Vad är skillnaden mellan att vågfunktionen har noll i amplitud och ett nodplan?
5) Hur ska man se på att vågfunktionen har noll i amplitud?
1. För att vågfunktionen är 0 när r = 0 för alla orbitaler som inte är s-orbitaler. Sannolikheten att hitta en elektron någonstans är proportionell mot värdet av Schrödinger-funktionen i kvadrat, så om Schrödinger-ekvationen har värdet 0 någonstans s är sannolikheten 0 att hitta en elektron där.
2. Jovisst, eller vänder där.
3. Ja, men inte för r = 0.
4. Det är olika sätt att uttrycka samma faktum.
5. Att sannolikheten att hitta en elektron i den aktuella positionen är 0.


