Orbitaler: 4s innan 3d
Hej!
Jag har precis börjat läsa om orbitaler och elektronkonfiguration m.m., och som jag förstår det, och som man kan se i ett sådant "schema" som bilden nedan, så fylls 4s orbitalen upp innan 3d orbitalerna, eftersom att 4s är lite lägre energinivå än 3d, trots att det är den yttre energinivån (n=4).
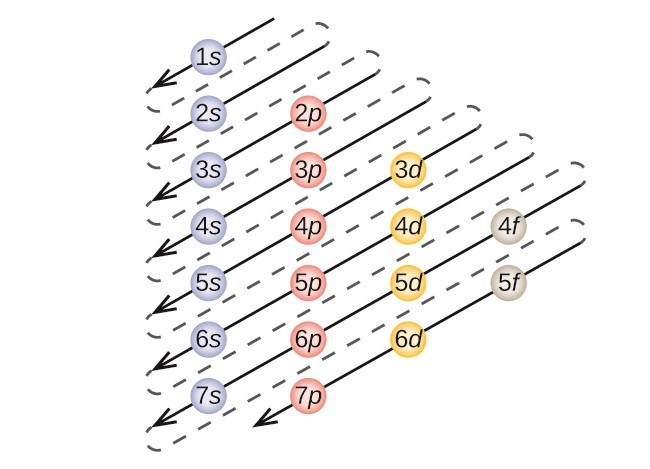
Stämmer detta för alla grundämnen (med undantag för typ Cr, Cu och några andra som fylls upp lite annorlunda), att de fylls på i denna ordningen? För när jag läser om elektronkonfigurationen för Fe och Fe2+ så blir de följande;
Fe: [Ar] 3d6 4s2
Fe2+: [Ar] 3d6
Alltså är det 4s som "töms" först när Fe bildar en jon, trots att den då enligt schemat fylls på först. Det som fylls på först borde ha lägre energi enligt Aufbau principen, men samtidigt bör ju det som töms först ha högre energi, vilket då säger emot varandra. Jag har försökt förstå varför det är såhär, och om jag förstått det rätt så tolkar jag det som att för Fe är 4s en högre energinivå än 3d (därför töms den före), men den fylls ändå på först. Stämmer det? Och vilka ämnen gäller det isåfall för? Eller vad är anledningen till att 4s töms först för Fe men fylls också på först? Eller töms alltid 4s före 3d när ett grundämne ska bilda jon?
Jag förstår att anledningen till att nivåerna får olika energinivåer och sådär är lite mer komplicerat, men jag är mest intresserad av att kunna förstå det tillräckligt bra för att veta hur man bestämmer elektronkonfigurationen.
Så kort sagt:
Fylls alla grundämnen på enligt schemat?
Men vissa (eller alla?) "töms" (när det ska bildas joner) inte enligt schemat, utan då beror det på om 4s faktiskt har lägre eller högre energi än 3d för just det ämnet? Och för vilka ämnen har isåfall 4s högre energi?
Aufbau-principen är en regel för hur elektronerna fördelas när man bygger upp en neutral atom, men de säger egentligen ingenting om i vilken ordning elektronerna joniseras. Det är alltså skillnad mellan att bygga upp en järnatom eller en järnjon, för orbitalernas energier är inte identiska i dessa fall. I en järnjon finns överskott av positiv laddning vilket drar orbitalerna närmre kärnan och förändrar deras energinivåer. En järnjon som har avgett 4s-elektroner har lägre energi än en järnjon som har avgett 3d-elektroner visar experiment. Det är alltså svårt att förutse sånt här teoretiskt, utan man måste göra experiment för att se vad som egentligen sker.


