Oxidation av etanol och kaliumpermanganat
Hej!
Jag har gjort en laboration där fast kaliumpermanganat (KMnO4) har blandats med en lösning av etanol och destillerat vatten och sedan upphettats.
Jag undrar om mitt resonemang stämmer:
1. KMnO4 oxiderar etanolen samtidigt som etanolen reducerar KMnO4
2. Första protonen (H+) från etanol (den på OH-gruppen) går till syreatomen på permanganatgruppen
Några ytterligare frågor:
Jag har hittat en reaktionsformel under antagandet att det är etanal som bildats och jag har några ytterligare frågor angående den.
3 C2H5OH + 2 KMnO4 → 3 CH3CHO + 2 H2O + 2 KOH + 2 MnO2
1. Vad händer med den andra protonen (H+) från etanolen?
2. Hur bildas KOH respektive MnO2?
3. Hur och varför separeras K+ och MnO4?
Tack på förhand!
linsun06 skrev:Hej!
Jag har gjort en laboration där fast kaliumpermanganat (KMnO4) har blandats med en lösning av etanol och destillerat vatten och sedan upphettats.
Jag undrar om mitt resonemang stämmer:
1. KMnO4 oxiderar etanolen samtidigt som etanolen reducerar KMnO4
Nja, en kolatom i etanolen oxideras från alkohol till aldehyd samtidigt som manganen i permanganatjonen reduceras trån ox.tal +VII till +IV, d v s tre steg. Kaliumjonerna ändras inte.
2. Första protonen (H+) från etanol (den på OH-gruppen) går till syreatomen på permanganatgruppen
Två syren från permanganatjonen reagerar med vätena från etanolen så att det bildas hydroxidjoner.
Några ytterligare frågor:
Jag har hittat en reaktionsformel under antagandet att det är etanal som bildats och jag har några ytterligare frågor angående den.
3 C2H5OH + 2 KMnO4 → 3 CH3CHO + 2 H2O + 2 KOH + 2 MnO2
1. Vad händer med den andra protonen (H+) från etanolen?
Den reagerar också med syren från permanganatjonen. Varken vätena eller syret ändra sina oxidationstal.
2. Hur bildas KOH respektive MnO2?
Kaliumjonerna kommer från kaliumpermanganatet. Syret i hydrixidjonen kommer från permanganatjonen, coh vätet i hydroxidjonen från etanolen. Manganet och oxidjonerna i brunstenen kommer från permanganatjonen.
3. Hur och varför separeras K+ och MnO4?
När man löser ett salt i vatten delar saltet upp sig i sina joner.
Tack på förhand!
Att permanganatjonen reduceras tre steg, innebär det att den tar upp tre elektroner? Isåfall var tas dessa elektroner ifrån och hur går det till?
Ytterligare en fråga: hur bildas hydroxidjoner av syret från permanganatjonen och vätet från etanolen?
linsun06 skrev:Att permanganatjonen reduceras tre steg, innebär det att den tar upp tre elektroner? Isåfall var tas dessa elektroner ifrån och hur går det till?
Från kolatomen i "alkohol-kolatomen", som oxideras till en aldehyd.
Ytterligare en fråga: hur bildas hydroxidjoner av syret från permanganatjonen och vätet från etanolen?
Genom att det bildas en kovalent bindning (elektronpar-binding).
Stämmer den här bilden över vad som händer?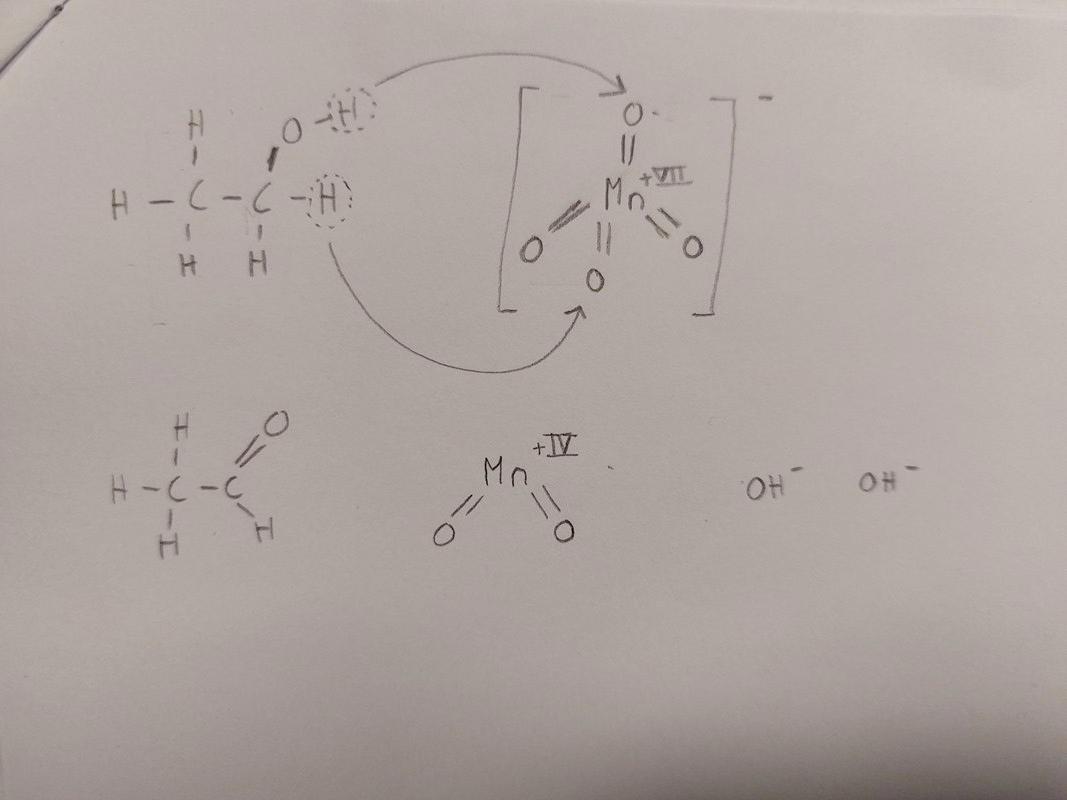
Stämmer mitt resonemang?
1. En vätejon kan relativt enkelt "bryta sig loss" från syreatomen på OH-gruppen på etanolen eftersom syre har högre elektronegativitetsvärde och därmed attraherar de gemensamma elektronerna starkare.
2. Den fria vätejonen reagerar med en syreatom på permanganatjonen och bildar en hydroxidjon genom att binda kovalent bindning till varandra.
3. Vad är det som får den andra vätejonen (från väteatomen på etanol) att "bryta sig loss"? Kol och väte har väl ungefär samma elektronegativitetsvärde och drar i de gemensamma elektronerna ungefär lika mycket.
4. Den andra vätejonen reagerar med en annan syreatom på permanganatjonen och bildar en hydroxidjon.
Kolatomen reduceras tre steg och blir därmed av med tre elektroner. Om man tittar på strukturformeln för etanol, var kommer dessa elektroner ifrån, alltså vilka kovalenta bindningar kommer de ifrån?
linsun06 skrev:Stämmer den här bilden över vad som händer?
Stämmer mitt resonemang?
1. En vätejon kan relativt enkelt "bryta sig loss" från syreatomen på OH-gruppen på etanolen eftersom syre har högre elektronegativitetsvärde och därmed attraherar de gemensamma elektronerna starkare.
Nej, etanol är en väldigt svag syra, så det händer inte. Det gör att resten av din förklaring inte heller stämmer.
2. Den fria vätejonen reagerar med en syreatom på permanganatjonen och bildar en hydroxidjon genom att binda kovalent bindning till varandra.
3. Vad är det som får den andra vätejonen (från väteatomen på etanol) att "bryta sig loss"? Kol och väte har väl ungefär samma elektronegativitetsvärde och drar i de gemensamma elektronerna ungefär lika mycket.
4. Den andra vätejonen reagerar med en annan syreatom på permanganatjonen och bildar en hydroxidjon.
Kolatomen reduceras tre steg och blir därmed av med tre elektroner. Om man tittar på strukturformeln för etanol, var kommer dessa elektroner ifrån, alltså vilka kovalenta bindningar kommer de ifrån?
Okej.
Isåfall skulle du vilja förklara hur det går till? Lite mer specifikt än tidigare.
Tack för hjälpen!
I nästa steg i laborationen blandades svavelsyra till produkterna så att en karboxylsyra bildades.
I sur miljö blir premanganatjoenr till Mn3+, så om lösningen surgörs kan troligen brunstenen MnO2 reduceras vidare till manganjoner. Samma kolatom som tidigare oxideras ännu mer.



