Oxidation och reduktion
För att excitera natriumatomen för att den ska bli en natriumjon krävs det att man tillför energi (joniseringsenergi). Är oxidation då ett exempel på en endoterm reaktion? Samtidigt får en exciterad natriumatom ett fyllt yttersta elektronskal, och därmed lägre energi. Den högre energin atomen hade innan, borde inte den avges till omgivningen? Dvs att reaktionen faktiskt avger energi.
Du glömmer att ta hänsyn till elektronens energi!
Så man tillför först energi till elektronen så att den avlägsnas från atomen. När elektronen har avlägsnats blir det en starkare attraktionskraft till de kvarstående elektronerna vilket innebär att de hålls stabilare fast, elektronerna får lägre energi och samtidigt får atomen som helhet får lägre energi. Men ingen energi avges i reaktionen?
Energiförloppet av kemiska reaktioner präglas ofta att det finns en övergångstillstånd som kräver aktivering till en högre energinivå. Energin som är nödvändig att nå denna övergångstillstånd kallas aktiveringsenergi. Sedan kan produkterna har en lägre energinivå än utgångsmaterialet och då är det en exoterm reaktion ("det blir varm").
Aktiveringsenergin sätts alltså fri igen.
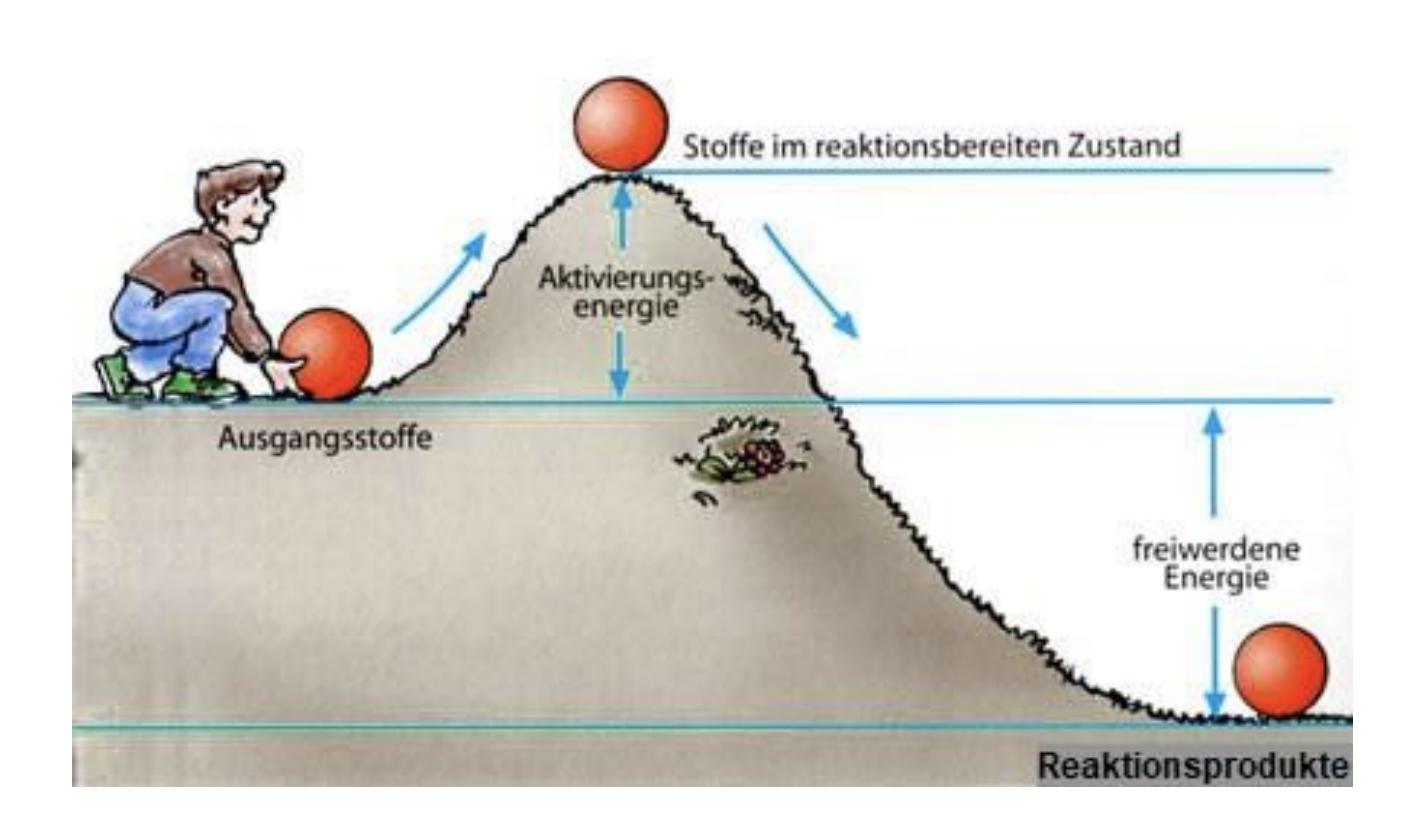
Enligt bilden verkar det nästan som att det frigörs mer energi än vad som krävdes för att starta reaktionen (aktiveringsenergin). Motsvarar detta att atomen, i sitt nya tillstånd, har lägre energi eftersom den har ett fullt yttersta elektronskal och därmed mindre reaktiv?
Det beror allt på processen man betraktar.
Vanligtvis använder man modellen här för kemiska reaktioner där man har flera reaktionspartner, inte bara en enda.
Om exempelvis vätegas reagerar med syregas så är det en exoterm reaktion och värme avges.
Du måste ta hänsyn till alla reaktanter och alla produkter för att det skall stämma!
Här finns mer allmän info om reaktionens energiförlopp
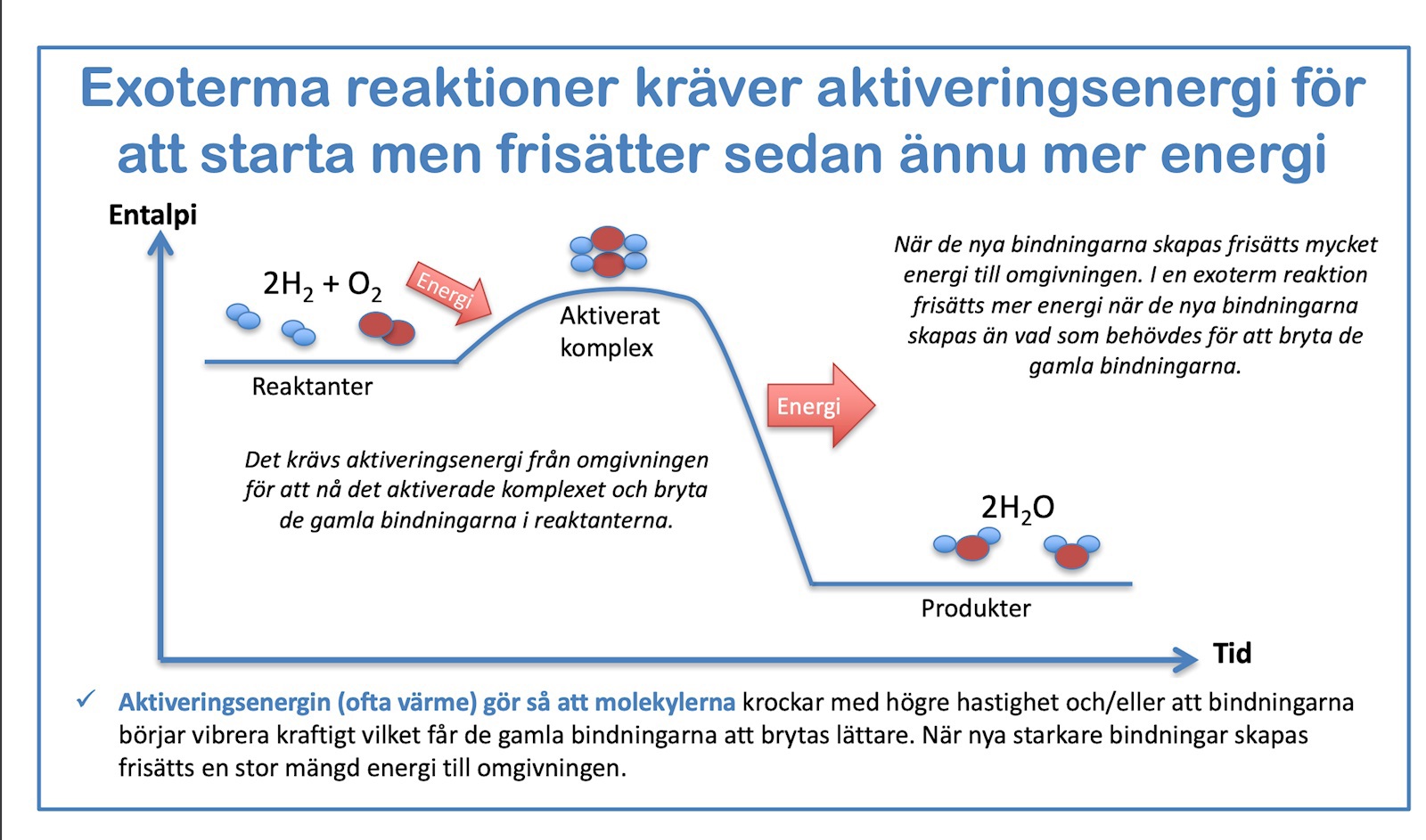
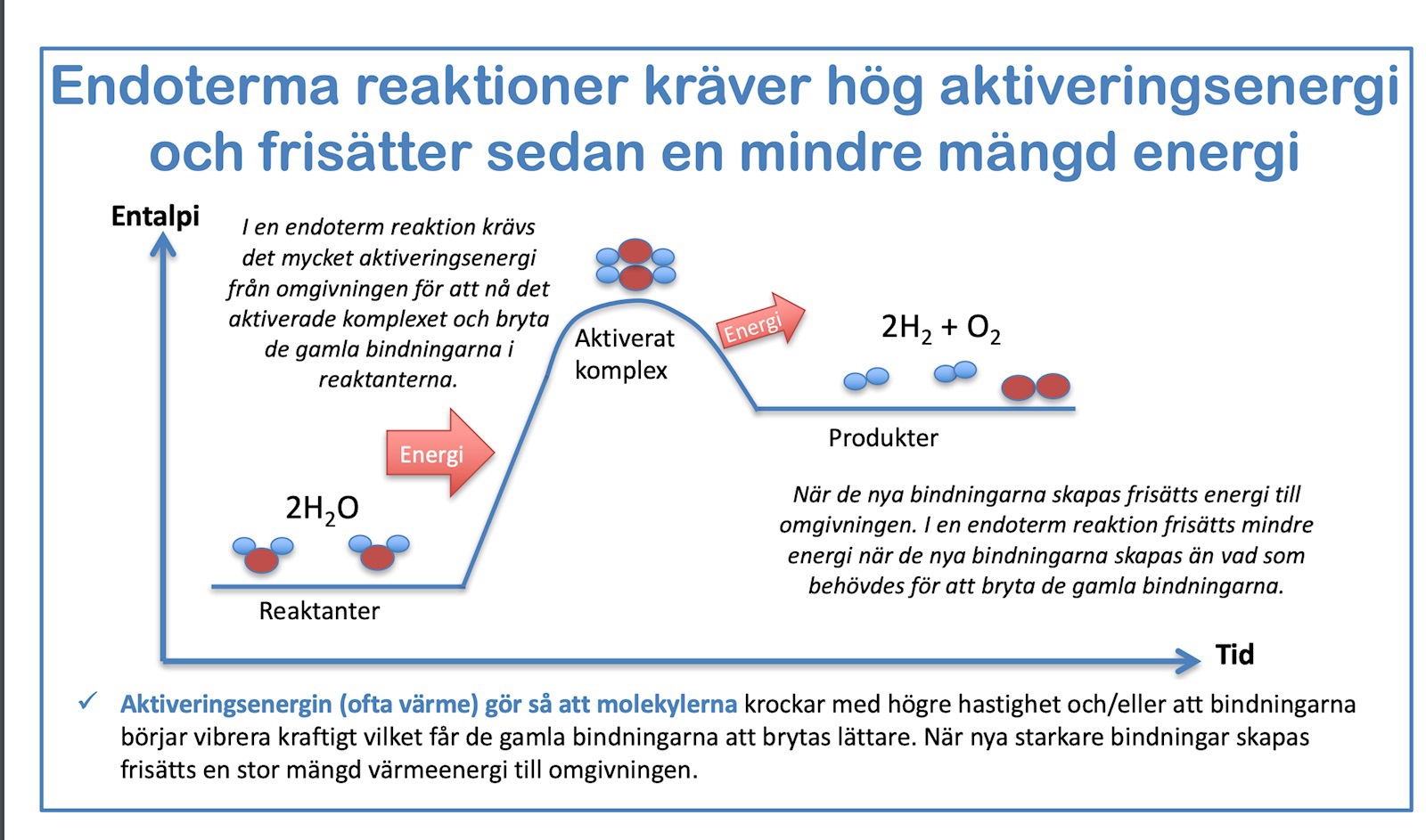
https://kemilektioner.se/wp-content/uploads/2016/02/Kemiska-reaktioner-och-reaktionshastigheter.pdf
Så, om man delar upp reaktionen och reaktanterna, när frisätts det och när krävs det energi?
Man kan inte delar upp det så där.
Det är som att kasta boll mellan två personer.
Vad händer om bara den kastande finns eller bara den mottagande?



