Oxidation samt vätebindningar
Hej!
1. När hela atomer avges till omgivningen som exempelvis vid bildning av disulfidbryggor extracellulärt räknas det som oxidation? Är inte kriteriet för oxidation att en molekyl avger en eller flera elektron(er) och inte en eller flera hel(a) atom(er)?
2. Min bok säger att en karbonyl-grupp kan bilda vätebindning med en hydroxylgrupp från en annan aminosyra. Hur kan karbonylgruppen som endast består av kol dubbelbundet till syre ha vätebindningar med omgivningen?
1. Jag förstår inte vad du menar. Om jag får ta ett exempel med reduktion istället, så kan en permanganatjon reduceras till manganjon samtidigt som det avges en massa syreatomer (som bildar vatten i den sura lösningen).
2. Syret har två fria elektronpar som kan binda till väteatomer i exempelvis vatten. Däremot kan inte två karbonylgrupper bilda vätebindningar till varandra.
smaragdalena skrev :1. Jag förstår inte vad du menar. Om jag får ta ett exempel med reduktion istället, så kan en permanganatjon reduceras till manganjon samtidigt som det avges en massa syreatomer (som bildar vatten i den sura lösningen).
2. Syret har två fria elektronpar som kan binda till väteatomer i exempelvis vatten. Däremot kan inte två karbonylgrupper bilda vätebindningar till varandra.
1. Jag menar hur detta räknas som oxidation (redoxreaktion) då 2H+ och 2 e- egentligen är 2H:
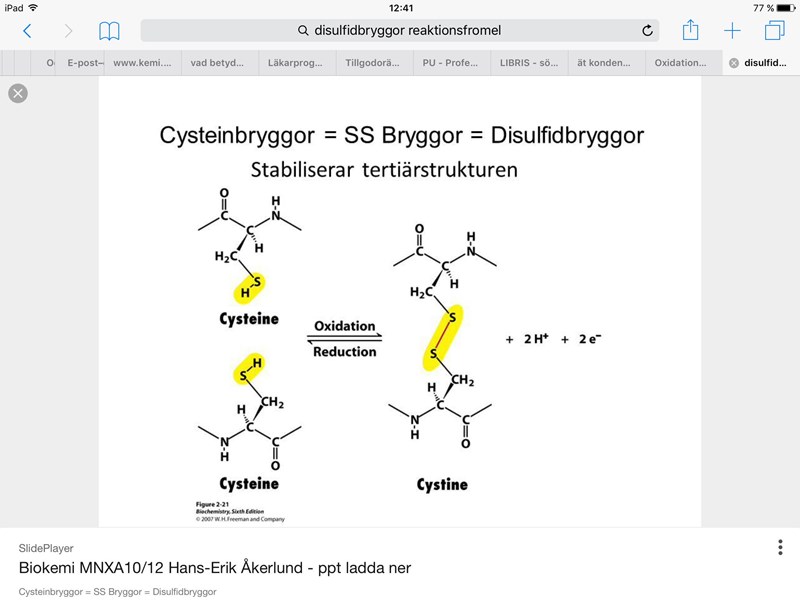
(en tilläggsfråga, var tar de två väteatomerna vägen vid disulfidbryggbindningen?)
2. Kan det alltså ske vätebindingar så länge det finns åtminstone 1 väteatom mellan två starkt elektronegativa atomer? Till exempel sker vätebinding mellan karbonyl och hydroxylgrupp för att väteatomen ligger mellan dem?
1. Du kan se att det har försvunnit 2 elektroner vid reaktionen, så molekylen har oxiderats. Det är två elektroner och två vätejoner som har lämnat molekylerna, inte två väteatomer (eller en vätgasmolekyl).
2. Vätebindningar bildas mellan en molekyl som har en väteatom som är bunden till F, O eller N (donor) och en molekyl som har fria elektronpar som kan binda till vätet (acceptor). En karbonulgrupp kan bara vara acceptor. En hydroxylgrupp kan vara både donor och acceptor.
smaragdalena skrev :1. Du kan se att det har försvunnit 2 elektroner vid reaktionen, så molekylen har oxiderats. Det är två elektroner och två vätejoner som har lämnat molekylerna, inte två väteatomer (eller en vätgasmolekyl).
2. Vätebindningar bildas mellan en molekyl som har en väteatom som är bunden till F, O eller N (donor) och en molekyl som har fria elektronpar som kan binda till vätet (acceptor). En karbonulgrupp kan bara vara acceptor. En hydroxylgrupp kan vara både donor och acceptor.
1. Det jag kan se är att det borde ha försunnit vätgas då -SH (tiolgrupperna) i respektive Cysteine blir till en dipeptid och det blir en gemensam -S-S- brygga, det vill säga att två väteatomer saknas?
2. N,O, F kommer jag ihåg men hur kan en hydroxylgrupp vara även acceptor i andra fall?
(Har läst om donor och acceptor men förstår inte exakt vad de betyder, kan du förklara för mig?)
1. Du antar att elektronerna som frigörs på något sätt hör ihop med vätejonerna, men det gör de inte. Ämnet som bildar svavelbryggan tappar två elektroner OCH två vätejoner. Eftersom det tappar elektroner har det oxiderats. Elektronerna och vätejonerna kan tas upp av helt olika ämnen och behöver inte ha något med varandra att göra.
2. En vätebindning uppstår eftersom atomerna F, O och N drar till sig väteatomens elektron så pass starkt att väteatomen kan lossna helt och bilda en vätejon. Den kan då tas upp av en F, O eller N-atom någon annanstans, vilket ger upphov till en negativt laddad jon (där vätejonen lossnade) och en positivt laddad jon (där vätejonen plockades upp). Det skapas då en rätt stark attraktion mellan plus och minus (i grunden samma sak som i en jonbindning). Vätejonen kan dock återgå till sin ursprungliga plats fram och tillbaka, så attraktionen blir inte alls lika stark som i en vanlig jonbindning. Däremot blir den betydligt starkare än andra typer av intermolekylära bindningar där atomer inte lossnar från molekyler.



