Oxidationstal
Hej
Jag läser om oxidation och reduktion men det är en sak jag inte fattar. Om jag ska balansera en formel med hjälp av oxidations tal hur räknar jag vilket ämne som har vilket oxidationstal? Jag vet att det finns några regler som att oxidations talet för rena grundämnen är noll och oxidations före syre är -2 och för väte +1 men jag fattar fortfarande inte.
Tack på förhand
Det gäller att följa reglerna, här finns de flesta
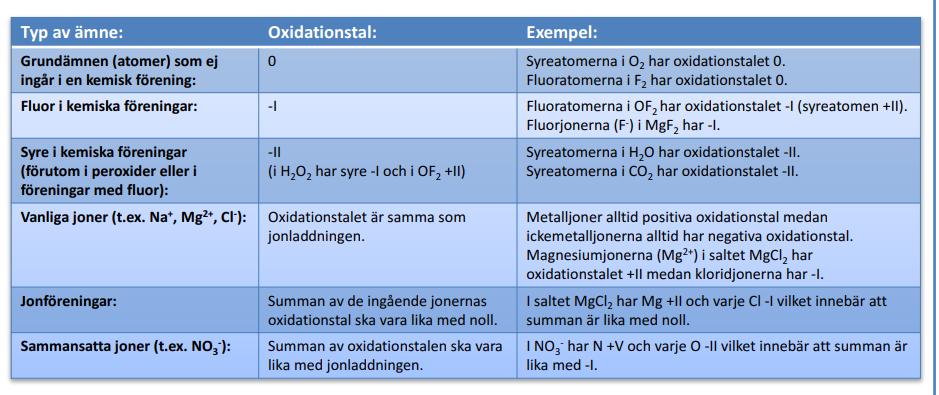
har du frågor, så fråga på!
Måste man memorisera det här eller är det något som man alltid får med?
TEDIT: till exempel
Namnge P2O5 med kemiska räkneord och med oxidationstal
Hur vet jag vad oxidations talet blir här?
Mattee skrev:Måste man memorisera det här eller är det något som man alltid får med?
Jag tror inte man får ut oxidationsreglerna på ett prov (det har inte vi fått iallafall). Det gäller att memorisera de och förstå hur man ska använda de. Du kommer finna mönster på det när du stöter på olika uppgifter kring hur du ska tänka.
TEDIT: till exempel
Namnge P2O5 med kemiska räkneord och med oxidationstal
Hur vet jag vad oxidations talet blir här?
Har du själv någon tanke?
Visa spoiler
Börja med att ta ut oxidationstalet för syre.
Oxidationstalet för syre är -2. Men fosfor? hur vet jag vad oxidationstalet för fosfor är?
Mattee skrev:Oxidationstalet för syre är -2. Men fosfor? hur vet jag vad oxidationstalet för fosfor är?
Tänk på helhetsladdningen.
Summan av jonernas oxidationstal i en jonförening ska vara lika med 0.
Eftersom syre har oxidationstalet -2, kan du nu räkna ut den "totala laddningen" syre har. Har du någon tanke på hur du kan göra?
Måste fosfor ha oxidationstalet 2 i så fall. Så att den totala laddningen blir 0.??
Mattee skrev:Måste fosfor ha oxidationstalet 2 i så fall. Så att den totala laddningen blir 0.??
Nej, du har totalt 5 syre, varje syre har oxidationstalet -2, den totala laddningen blir därför (-2 * 5 = -10)
Därför måste fosforns totala laddning bli +10, och du har 2 fosfor, alltså blir oxidationstalet 10/2= 5.
Är du med på det? Om inte så fråga gärna.
naturnatur1 skrev:Mattee skrev:Måste fosfor ha oxidationstalet 2 i så fall. Så att den totala laddningen blir 0.??
Nej, du har totalt 5 syre, varje syre har oxidationstalet -2, den totala laddningen blir därför (-2 * 5 = -10)
Därför måste fosforns totala laddning bli +10, och du har 2 fosfor, alltså blir oxidationstalet 10/2= 5.
Är du med på det? Om inte så fråga gärna.
Jag fattar tills du börjar förklara det jag har fetmarkerat. Fattar inte riktigt varför?
Mattee skrev:naturnatur1 skrev:Mattee skrev:Måste fosfor ha oxidationstalet 2 i så fall. Så att den totala laddningen blir 0.??
Nej, du har totalt 5 syre, varje syre har oxidationstalet -2, den totala laddningen blir därför (-2 * 5 = -10)
Därför måste fosforns totala laddning bli +10, och du har 2 fosfor, alltså blir oxidationstalet 10/2= 5.
Är du med på det? Om inte så fråga gärna.
Jag fattar tills du börjar förklara det jag har fetmarkerat. Fattar inte riktigt varför?
Pb2O5 säger oss att vi har 2 bly och 5 syre.
Syret är vi överens om, varje syreatom har oxidationstalet -2, och vill vi ha "totala laddningen" för alla syre så blir det ( -2 * 5 = -10)
Bly måste därför ha den "totala laddningen" +10. Med tanke på att vi endast har 2 bly så kommer laddningen att delas mellan dessa. För enstaka får vi alltså fram 10/2 = +5.
(( Om du exempelvis hade haft 5 bly istället, och samma laddning (+10) som du vill hitta oxidationstal för enstaka bly, så hade du istället tagit 10/5=2, då hade oxidationstalet varit 2. ))
Men eftersom det är +10 vi vill nå fram, och vi endast har 2 bly, så får vi fram för enstaka bly (10/2 =5)
Hoppas det inte blev rörigt.
naturnatur1 skrev:Mattee skrev:Måste fosfor ha oxidationstalet 2 i så fall. Så att den totala laddningen blir 0.??
Nej, du har totalt 5 syre, varje syre har oxidationstalet -2, den totala laddningen blir därför (-2 * 5 = -10)
Därför måste fosforns totala laddning bli +10, och du har 2 fosfor, alltså blir oxidationstalet 10/2= 5.
Är du med på det? Om inte så fråga gärna.
Tack så jätte mycket jag fattar men det är bara en sak jag märkte. Som jag citera ovan. Förut prata vi om fosfor och nu om bly. Var försvann fosfor eller var det aldrig fosfor?
EDIT: Finns det någon åskådarjon i formeln?
Mattee skrev:naturnatur1 skrev:Mattee skrev:Måste fosfor ha oxidationstalet 2 i så fall. Så att den totala laddningen blir 0.??
Nej, du har totalt 5 syre, varje syre har oxidationstalet -2, den totala laddningen blir därför (-2 * 5 = -10)
Därför måste fosforns totala laddning bli +10, och du har 2 fosfor, alltså blir oxidationstalet 10/2= 5.
Är du med på det? Om inte så fråga gärna.
Tack så jätte mycket jag fattar men det är bara en sak jag märkte. Som jag citera ovan. Förut prata vi om fosfor och nu om bly. Var försvann fosfor eller var det aldrig fosfor?
Ursäkta, det är fel av mig! Jag tänkte det stod Pb, men det är fosfor (P) det snackas om. Det har du helt rätt i. Jag menade fosfor, inte bly.
EDIT: Finns det någon åskådarjon i formeln?
Nej, med tanke du endast ska hitta oxidationstal. Åskådarjoner finner du kemiska reaktioner, det är joner som finns med i omgivningen där en kemisk reaktion äger rum men som inte själv deltar i reaktionen.
Tack så jätte mycket. Jag fattar nu!

