Oxidationstal?
Hej! Jag undrar hur man ska tänka för att ta reda på oxidationstalen? Jag förstår att man ska titta på elektronnegativiteten samt vilken grupp ämnet tillhör. Exempelvis så får syre oxidationstal -2 eftersom den tillhör grupp 6 och vill alltså ta upp 2 elektroner för att få oktet. Jag förstår dock inte varför Mn har oxidationstal +2 i Mn(ClO)2? Borde den inte ha oxidationstal -1 eftersom den tillhör grupp 7 och borde vilja ta upp en elektron? Jag undrar även från vilket tal det är man tänker sig att de ska vilja ta upp eller ge ifrån sig elektroner? Har för mig att om de har 4 eller fler valenselektroner så vill de ta upp? och 1,2 eller 3 valenselektroener så vill de ge ifrån sig?
Här är en fråga jag stötte på:

Här är facit:
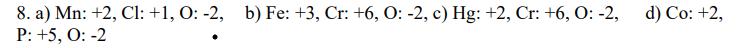
Tack på förhand!
Den metod du beskriver fungerar bara för grupp 1, 2 samt 16, 17. För övriga grupper måste man använda uteslutningsmetoden för att bestämma oxidationstal. I a) måste du identifiera att ämnet är mangan(II)hypoklorit. Hur vet man det? Jo, för att det är en jonförening (metall med icke-metaller) samtidigt som "ClO" skvallrar om att ämnet innehåller hypokloritjoner (ClO-). Då en hypokloritjon har laddningen -1 och det finns två sådana måste manganjonen balansera laddningen 2*(-1)=-2. Alltså har manganjonen laddningen +2 och följaktligen oxidationstalet +2.


