Oxidationstalsmetoden med kaliumpermanganat och oxalsyra
Hej!
Jag försöker lösa denna uppgift: "Kaliumpermanganat (KMnO4) reagerar med oxalsyra (H2C2O4) i sur lösning varvid mangan(II)joner och koldioxid bildas. Skriv en balanserad reaktionsformel för reaktionen."
Jag förstår att oxidationstalsmetoden skall användas, varför jag började med att skriva ut oxidationstalen. Kalium är en åskådarjon.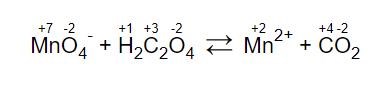 (Oxidationstalen är här skrivna med arabiska siffror trots att det ska vara romerska sådana).
(Oxidationstalen är här skrivna med arabiska siffror trots att det ska vara romerska sådana).
Därefter konstaterade jag att:
Mangan reduceras med en ändring i oxidationstal på -5.
Kol oxideras med en ändring i oxidationstal på +1.
För att dessa ändringar ska kompensera varandra satte jag ut "5" (den minsta gemensamma nämnaren) framför oxalsyran och koldioxiden.
Sedan lade jag till 3 H3O+ för att balansera jonladdningen, men detta gör att det blir heltokigt när jag ska balansera antalet H med H2O, eftersom jag då har 19 H i vänster led och därför skulle behöva lägg till 9,5 H2O i höger led.
Vad har jag gjort för fel?
Du har missat att det är två kolatomer i oxalsyra, som oxideras ett steg vardera. Det behövs alltså 2 permanganatjoner och 5 oxalsyra för att det skall väga jämnt.
Tack.
Då blir det alltså: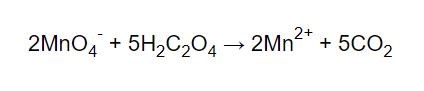 Och när man balanserar jonladdningen med H3O+:
Och när man balanserar jonladdningen med H3O+:
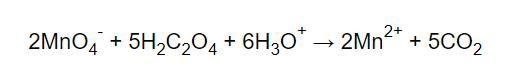
Och till sist efter balans av väte med H2O:
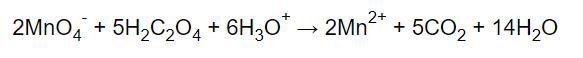
Enligt oxidationstalsmetoden bör då antalet syre vara lika stort i höger och vänster led, men det är det inte. Har jag missat något?
Det bildas 2 koldioxid från varje oxalsyra.
2 MnO4- + 5 H2C2O4 => 2 Mn2+ + 10 CO2
På vänstersidan är det 28 syreatomer, på högersidan är det 20. Det blir 8 vatten på högersidan, så 16 väten, men det finns redan 10 stycken i oxalsyran.
2 MnO4- + 5 H2C2O4 + 6 H+ => 2 Mn2+ + 5 CO2 + 8 H2O.
Laddningen är +4 på vänstersidan och +4 på högersidan, så det stämmer.
Jag brukar balansera i den här ordningen, men det fungerar naturligtvis lika bra så som du gör.


