pH för lösning med amfolyt
Hur beräknar man pH värde om det bildas en amfolyt när ett salt löser upp sig i vatten? Tar man hänsyn till det eller beräknar man bara pH-värdet "som vanligt", alltså med koncentrationen [H3O+]?
Den praktiska frågan är egentligen: 1,5 g NaC2HO4 löses upp i vatten och späds till 50 ml. Beräkna pH-värdet av denna lösning.
Jag har skrivit:
NaC2HO4 -> Na+ + C2HO4- när saltet löses upp i vatten. [C2HO4-] = 0,267 M
Sedan tänker jag att C2HO4- är en amfolyt eftersom den både kan ta upp H och avge H. Då borde båda reaktionerna nedan kunna ske med H2O:
C2HO4- + H2O H3O+ + C2O42-
C2HO4- + H2O ⇌ OH- + C2H2O4
Ska jag då sätta upp jämviktsekvation för båda reaktionerna och räkna ut [H3O+] som skapas i båda reaktionerna och sedan addera dessa och beräkna pH genom -log[H3O+]? Jag är tveksam till om detta verkligen är rätt...?
Är det oxalater det handlar om?
Börja med att ta reda på Ka- eller pKa-värden för alla aktuella syror.
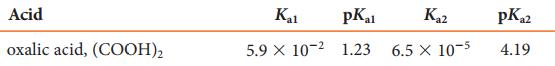
Och då har jag räknat på följande sätt:

Facit säger pH=2,7, så det är ju något som är lite tokigt.
Har du lärt dig rita logaritmiska diagram över de olika koncentrationerna? Det är i alla fall så jag skulle göra för att lösa den här uppgiften.
Nej, inte än i varje fall
Då blir det, om jag tänker rätt, ett ekvationssystem med fyra obekanta som man behöver lösa. De obekanta är koncentrationena av oxalat, väteoxalat, oxalsyra och oxoniumjoner (ellerhydroxidjoner - vet man det ena så vet man det andra) och ekvationerna är två syrakonstanter, en totalhalt och ett laddningsvillkor (det finns fler varianter).



