Hur långt har du kommit själv med uppgiften?
Jag själv vet inte exakt hur jag kan börja med den
Du kan anta att det bara är denna jämvikt som har betydelse:
Ställ upp en jämviktsekvation och klura på vad som händer med vätejonkoncentrationen om koncentrationen av koldioxid ökar med 10 procent.
Alltså jag förstår inte hur man gör
jag gjorde bara jämviktsekvation men sen vet jag inte hur man gör
Visa vad du har gjort och hur långt du har kommit, så kan vi hjälpa dig vidare. Har du hittat något värde på jämviktskonstanten?
Så här har jag gjort den som står om den inte stiger då är det den som är innan och sen det som står den stiger är det som är när pH stiger
På första pappret verkar du ha gjort rätt, men på andra pappret begriper jag inte vad du gör. Ändringen blir inte lika stor som i första fallet. Du känner inte till ändringen vid den högre CO2-halten utan du måste kalla den för +x respektive -x. Då får du en jämviktsekvation tillsammans med ditt framtagna K-värde där du kan bestämma x och därmed nya [H+] vid jämvikt.
Men allt det här är ändå ganska mycket ”onödigt” arbete, för man kan lösa uppgiften utan att ta reda på värdet på K. De vill ju bara veta hur mycket pH-värdet ändras, inte vad pH-värdet blir. (Det står hur mycket pH-värdet stiger i uppgiften, men pH-värdet sjunker, så antagligen är det en tankevurpa hos den som gav dig uppgiften).
Visa lösningsförslag
Om du tittar på jämviktsekvationen kan du komma fram till att den nya vätejonkoncentrationen vid jämvikt blir om den tidigare koncentrationen vid lägre CO2-halt var .
Det betyder att ändringen i pH-värde blir
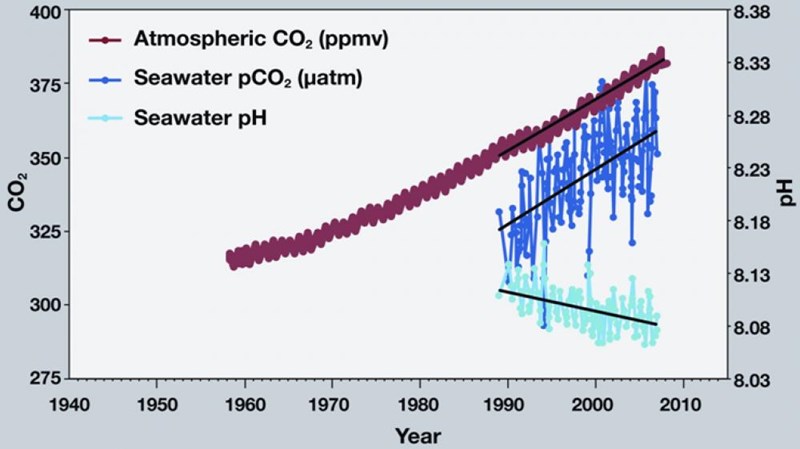
Dvs pH-värdet sjunker med ca 0,02 enheter om CO2-halten i atmosfären ökar med 10%. Det verkar också stämma ganska bra om man kollar på faktiska mätvärden:
Så vad kan jag göra nu för att lösa den
Hur fick du 1.1
Det enda som jag inte vet är kvadratroten av 1,1
Kan man anta att att koldioxidhalten i oceanen stiger med 10% för att den gör det i atmosfären?
Naby skrev:Det enda som jag inte vet är kvadratroten av 1,1
Gamla jämviktsekvationen:
Nya jämviktsekvationen efter att koldioxidhalten har ökat med 10% (dvs en förändringsfaktor på 1,1):
Laguna skrev:Kan man anta att att koldioxidhalten i oceanen stiger med 10% för att den gör det i atmosfären?
Ja, åtminstone i ytvattnet där det kan förutsättas råda jämvikt. Det är en direkt konsekvens av Henrys lag.
Tack så mycket
nu förstår jag men jag undrar om något varför skrev du - log kvadratroten 1.1 i den första lösningen som du visade och i den andra så skrev du bara kvadratroten av 1.1.
Juste varför behöver man ta kvadratroten kan någon förklara
Jag tog en genväg som kanske inte blev jättetydlig, men du kan tänka såhär:
Från början har du koldioxidkoncentrationen [CO2], vilken ökar med tio procent till 1,1[CO2]. När man ökar koldioxidkoncentrationen kommer det att bildas mer vätejoner och vätekarbonatjoner. Enligt formeln bildas det lika mycket vätejoner som vätekarbonatjoner. Vi kan kalla ändringen (förändringsfaktorn) för x och de ursprungliga koncentrationerna av vätejoner och vätekarbonatjoner för [H+] och [HCO3-]. Då får vi följande:
Jämviktsuttrycket i högra ledet motsvarar K, men det gjorde ju även jämviktsuttrycket vi hade tidigare, vid den lägre CO2-halten:
Vi kan därför sätta dessa uttryck lika med varandra:
Vilket går att förenkla till:
Det betyder att den nya vätejonkoncentrationen är .
Men är det svaret på frågan
Gör man så här till slut 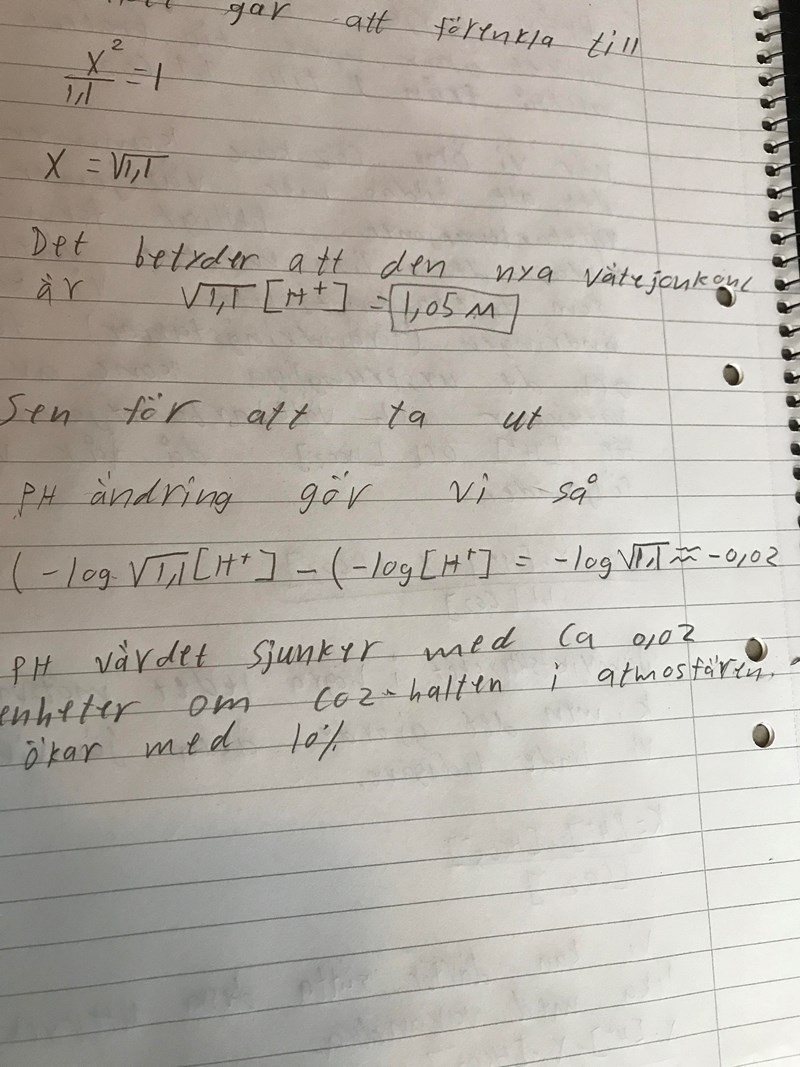
Det är kanske bättre att du struntar i min metod och kör vidare på det du gjorde från början. Du kommer att komma fram till samma svar, fast det tar längre tid. Men det är bättre att du förstår lösningen än att du ska skriva av en lösning du inte förstår.
Du har bestämt att jämviktskonstanten är ca 1,55*10^(-13). Vad blir då vätejonkoncentrationen om koldioxidhalten är 443,3 ppm istället för 403 ppm?
Ok men det som jag skrev på pappret är det rätt om jag kör på din metod
Halvrätt. Mittersta stycket där du beräknar vätejonkoncentrationen är fel. Den blir inte 1,05 M. Du kan inte beräkna en exakt koncentration med min metod, bara hur mycket pH-värdet ändras.
Precis det som jag vill att hur mycket den ändras







