Ph och koncentration

Jag har gjort såhär men vet inte hur jag ska gå vidare:
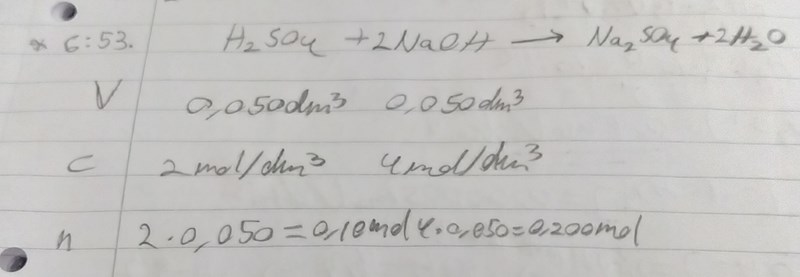
Tack i förhand!
lovisla03 skrev:
Jag har gjort såhär men vet inte hur jag ska gå vidare:
Tack i förhand!
Börja med att utgå från rätt ämnen. Det står saltsyra i uppgiften, inte svavelsyra!
Smaragdalena skrev:lovisla03 skrev:
Jag har gjort såhär men vet inte hur jag ska gå vidare:
Tack i förhand!
Börja med att utgå från rätt ämnen. Det står saltsyra i uppgiften, inte svavelsyra!
Nu ska det vara rätt
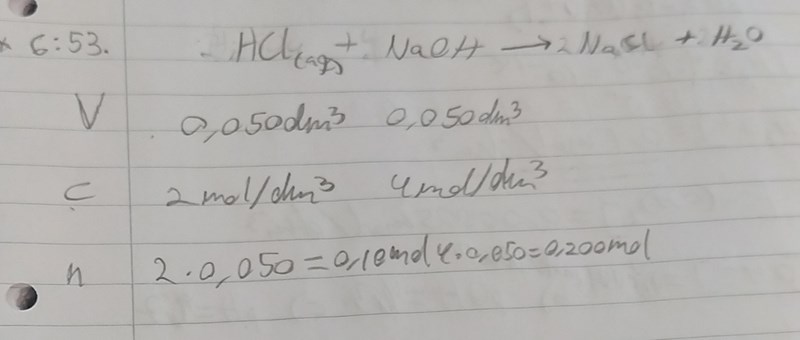
Hur många mol saltsyra har du från början? Hur många mol oxoniumjoner motsvarar det?
Hur många mol sNaOHa har du från början? Hur många mol hydroxidjoner motsvarar det?
Är det oxoniumjoner eller hydroxidjoner som är i överskott, d v s kommer blandningen att bli sur eller basisk?
Smaragdalena skrev:Hur många mol saltsyra har du från början? Hur många mol oxoniumjoner motsvarar det?
Hur många mol sNaOHa har du från början? Hur många mol hydroxidjoner motsvarar det?
Är det oxoniumjoner eller hydroxidjoner som är i överskott, d v s kommer blandningen att bli sur eller basisk?
1 mol saltsyra. Det motsvarar 3 mol oxoniumjoner?
1 mol NaOH. Det motsvarar 1 mol hydroxidjoner?
Oxoniumjoner är i överskott eftersom det bildas 3 mol oxoniumjoner och 1 mol hydroxidjoner?
Skriv reaktionsformler dels för när väteklorid reagerar med vatten, dels för när man löser upp NaOH i vatten. Du har rätt om den ena och fel om den andra (jag vill inte säga vilken som är vilken).
Smaragdalena skrev:Skriv reaktionsformler dels för när väteklorid reagerar med vatten, dels för när man löser upp NaOH i vatten. Du har rätt om den ena och fel om den andra (jag vill inte säga vilken som är vilken).
och vet inte hur jag gör när NaOH löser sig i vatten. Provade såhär: men lyckas inte balansera den.
Nej. NaOH är ett lättlösligt salt, det löser bara upp sig i vatten - det måste stå i din bok. NaOH(s)=> Na+(aq)+OH-(aq).
Smaragdalena skrev:Nej. NaOH är ett lättlösligt salt, det löser bara upp sig i vatten - det måste stå i din bok. NaOH(s)=> Na+(aq)+OH-(aq).
okej borde det inte bli -lg(2) då eftersom HCl reagerar med vatten är enda reaktionen där oxoniumjon bildas och pH=-lg? Och jag tänkte
När man löser upp fast NaOH i vatten så sker reaktonen NaOH(s) => Na+(aq)+ OH-(aq). Hur många mol hydroxidjoner finns det i 50 cm3 NaOH-lösning med koncentrationen 4 mol/dm3?
När man löser vätekloridgas i vatten så sker syrabasreaktionen HCl(g) + H2O => H3O+(aq)+Cl-(aq). Vätekorid är en stark syra, så det finns inga HCl-molekyler i lösningen. Hur många mol oxoniumjoner finns det i 50 cm3 saltsyra med koncentrationen 2 mol/dm3?
Börja med att svara på de frågorna så kan vi komma vidare därefter.
Smaragdalena skrev:När man löser upp fast NaOH i vatten så sker reaktonen NaOH(s) => Na+(aq)+ OH-(aq). Hur många mol hydroxidjoner finns det i 50 cm3 NaOH-lösning med koncentrationen 4 mol/dm3?
När man löser vätekloridgas i vatten så sker syrabasreaktionen HCl(g) + H2O => H3O+(aq)+Cl-(aq). Vätekorid är en stark syra, så det finns inga HCl-molekyler i lösningen. Hur många mol oxoniumjoner finns det i 50 cm3 saltsyra med koncentrationen 2 mol/dm3?
Börja med att svara på de frågorna så kan vi komma vidare därefter.
1) 4*0.050=0.200 mol hydroxidjoner
2) 2*0.050=0.10 mol oxoniumjoner
Vad händer när man blandar hydroxidjoner och oxoniumjoner med varandra? Skriv en reaktonsformel utan åskådarjoner.
Smaragdalena skrev:Vad händer när man blandar hydroxidjoner och oxoniumjoner med varandra? Skriv en reaktonsformel utan åskådarjoner.
Vet inte vilka som är åskådarjoner.
Bra, rätt formel. I det här fallet är det natriumjoner och kloridjoner som är åskådarjoner, men de spelar ingen roll eftersom de inte deltar i reaktionen.
Reaktionen sker tills den ena sortens joner tar slut. Vilket finns det kvar av efter reaktionen, hydroxidjoner eller oxoniumjoner?


