PH och Protolysgrad
Hej,
Jag har kört fast på denna fråga:
Beräkna pH samt protolysgraden i 0.020 M HF (pKa = 3.17). Protolysgraden anger hur många procent av HF som avgett sin proton.
En förklaring eller ledtråd på hur man beräknar protolysgraden hade varit uppskattad.
Tack på förhand.
Vad torr du hur man ska räkna den?
Filip Arnesson skrev:Vad torr du hur man ska räkna den?
Jag har försökt leta efter det i boken men hittar inget. Vet endast hur man räknar ut Ph-värdet. En ledtråd eller förklaring på hur man räknar ut protolysgraden hade varit upppskattad.
Vet du vad som menas med protolysgrad?
Ja, det är väll om ett ämne är fullständig eller ofullständig protolyserad.
Men hur räknar man ut det? Finns det en formel som man använder?
protolysgrad = (koncentrationen av korresponderande bas/totalhalten) .100%
Smaragdalena skrev:protolysgrad = (koncentrationen av korresponderande bas/totalhalten) .100%
protolysgrad = 3,17 / 0,020 * 100 % = 15850 = 1,58 * 10^4
Har jag räknat rätt nu?
Nej, det stämmer inte. Vilket pH-värde fick du fram? Fluoridjonkoncentrationen är samma som oxoniumjonekoncentrationen.
Smaragdalena skrev:Nej, det stämmer inte. Vilket pH-värde fick du fram? Fluoridjonkoncentrationen är samma som oxoniumjonekoncentrationen.
Så här räknade jag ut Ph-värdet:
H3O+ = 10^-0,020 = 0,95 = 1
Ph-värdet = 1
Det stämmer inte - HF är inte en stark syra. Du behöver använda dig av pKa-värdet för att räkna ut pH. Vet du hur du skall göra det?
Jag vet inte hur jag ska göra. Hur jag än försöker så blir det fel.
Smaragdalena skrev:Det stämmer inte - HF är inte en stark syra. Du behöver använda dig av pKa-värdet för att räkna ut pH. Vet du hur du skall göra det?
Ska jag använda OH- istället ?
Nej. Du vet att reaktionsformeln är HF + H2O <=> F- + H3O+. Det innebär att koncentrationerna av fluoridjoner och oxoniumjoner är lika. Om vi kallar koncentrationen av dessa joner för x, så blir koncentrationen av HF lika med 0,020-x. Sätt in dessa värden i uttrycket för Ka (du behöver räkna om pKa till Ka) och räkna ut x. När du vet oxoniumjonkoncentrationen kan du beräkna pH.
Om du behöver mer hjälp, så visa hur långt du har kommit och fråga igen.
Smaragdalena skrev:Nej. Du vet att reaktionsformeln är HF + H2O <=> F- + H3O+. Det innebär att koncentrationerna av fluoridjoner och oxoniumjoner är lika. Om vi kallar koncentrationen av dessa joner för x, så blir koncentrationen av HF lika med 0,020-x. Sätt in dessa värden i uttrycket för Ka (du behöver räkna om pKa till Ka) och räkna ut x. När du vet oxoniumjonkoncentrationen kan du beräkna pH.
Om du behöver mer hjälp, så visa hur långt du har kommit och fråga igen.
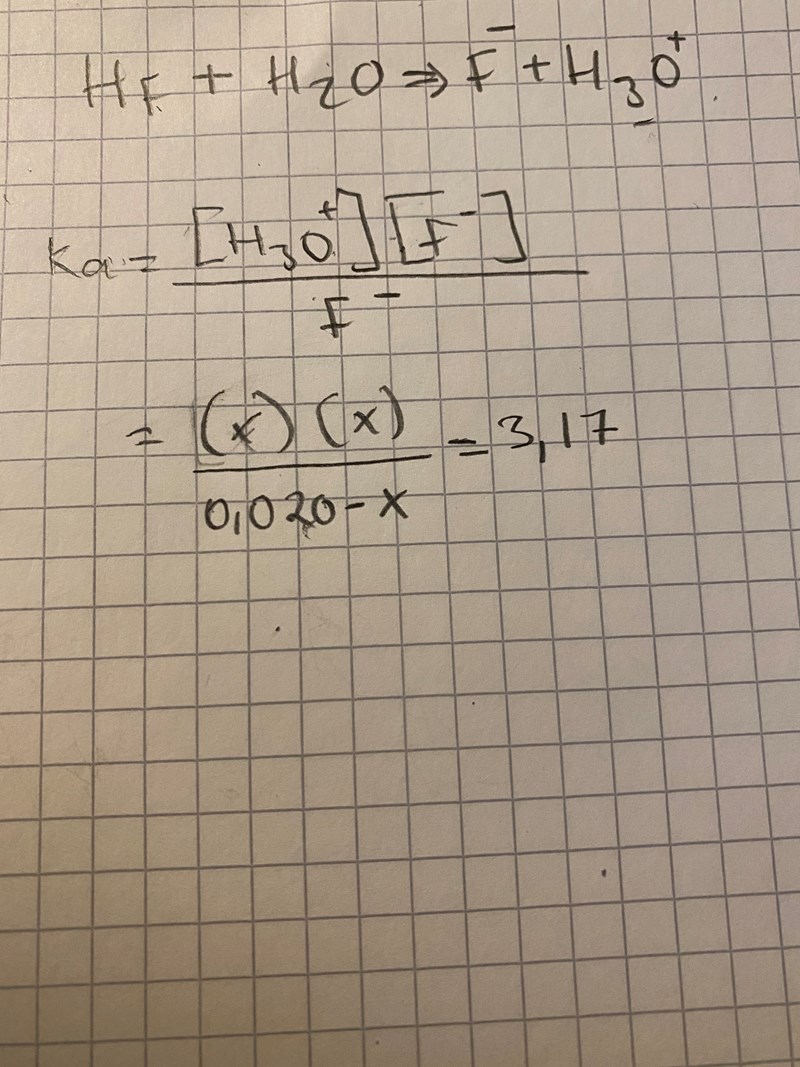
OBS: Det ska stå HF i nämnaren.
Nu har jag fastnat igen. Ser detta bra ut.
Nej, du skall ha Ka i HL, alltså 10-pKa.
Smaragdalena skrev:Nej, du skall ha Ka i HL, alltså 10-pKa.
Menar du Ka = 10^-0,02
Nej. Använd det värde på pKa som står i uppgiften (O,020 M är totalkoncentrationen).
Smaragdalena skrev:Nej. Använd det värde på pKa som står i uppgiften (O,020 M är totalkoncentrationen).
Menar du så här:
Ka = 10^-pKa M
Ka = 10^-3,17 = 0,000676083 M
Ja, förutom att Ka och pKa är enhetslösa.
Smaragdalena skrev:Ja, förutom att Ka och pKa är enhetslösa.
Så nu sätter jag in värdet på Ka
alltså :
Ka = (x)*(x) / 0,020 -x = 0,000676083
Sedan löser jag ut x värdet. Ska värdet på x användas för att räkna ut Ph-värdet ?
Du måste ha en parentes runt nämnaren för att det skall bli rätt.
Ja, x = [H3O+] = [F-].
Tusen tack för all hjälp.


