Ph värde beräkning
Hej!
Frågorna lyder:

Jag har löst 4, men får pH = 1.6 på 5. Det ska vara hälften så mycket, alltså 0.8…
Vad gör jag för fel?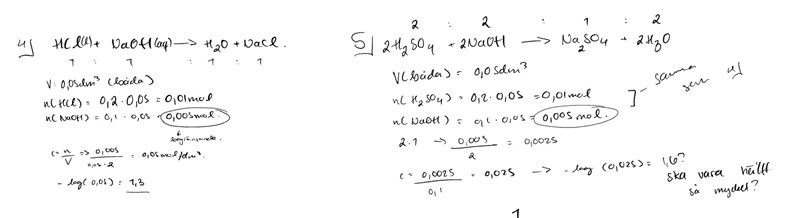 OBS! Gjort fel vid beräkning i reaktionsformel på 5);
OBS! Gjort fel vid beräkning i reaktionsformel på 5);
Skall stå H2SO4 + 2NaOH -> Na2SO4 + 2H2O
(tror jag) ….
Vad är skillnaden på dessa frågor?
naturar3 skrev:Hej!
Frågorna lyder:
Jag har löst 4, men får pH = 1.6 på 5. Det ska vara hälften så mycket, alltså 0.8…
Vad gör jag för fel?OBS! Gjort fel vid beräkning i reaktionsformel på 5);
Skall stå H2SO4 + 2NaOH -> Na2SO4 + 2H2O
(tror jag) ….
Vad är skillnaden på dessa frågor?
Det var elakt att ge dig den frågan! Svavelsyra är en stark syra i det första protolyssteget, men inte i det andra.
Om vi räknar med att svavelsyra är stark i båda stegen, så har vi 0,02 mol oxoniumjoner och 0,005 mol hydroxidjoner, d v s det är 0,015 mol oxoniumjoner i överskott. Koncentrationen av oxoniumjoner skulle bli 0,15 mol/dm3 så pH blir 0,82. Egentligen behöver man räkna med jämvikter och syrakonstanter för att få rätt svar, men det verkar som om ditt facit gjort så här.
Varför delade du substansmängden för hydroxidjoner med 2?
Varför delade du substansmängden för hydroxidjoner med 2?
Tror jag gick efter min första ”balanserade” reaktionsformel…. oops.
Jaha! Vi har inte lärt oss något om syrakonstanter… så jag vet inte riktigt.
I detta fall är det alltså ”överskottet” som blir den begränsande reaktanten… eller?
Hur skulle det sett ut om det istället var NaOH som hade ”överskott”? Är det 0.15 mol/dm^3 oxoniumjoner underskott då? Hur påverkar det beräkningen?
(UPPDATERING: Vänta.. om vi då räknar pH, är det väl alltid oxoniumjonerna man utgår ifrån? Alltså om nu scenariot var att NaOH är 0.2 mol/dm3 och HCl 0.2 mol/dm3, samt att förhållandet ligger 2:1 - skulle man då vara tvungen att beräkna pOH ( 14 - pOH ) för att ta reda på pH, då NaOH ligger i underskott? Hoppas jag inte ställer alt för många frågor nu…)
naturar3 skrev:Varför delade du substansmängden för hydroxidjoner med 2?Tror jag gick efter min första ”balanserade” reaktionsformel…. oops.
Jaha! Vi har inte lärt oss något om syrakonstanter… så jag vet inte riktigt.
Det hör till Ke2, så det är rimligt att du inte har lärt dig det. Du borde inte ha fått den här uppgiften, tycker jag, om man inte hade skrivit typ "räkna med att svavelsyra är stark i båda protolysstegen".
I detta fall är det alltså ”överskottet” som blir den begränsande reaktanten… eller?
När det finns överskott av oxoniumjoner blir det en sur lösning.
Hur skulle det sett ut om det istället var NaOH som hade ”överskott”? Är det 0.15 mol/dm^3 oxoniumjoner underskott då? Hur påverkar det beräkningen?
Om det finns hydroxidjoner i överskott så beräknar man först pOH och därefter pH so 14-pOH.
(UPPDATERING: Vänta.. om vi då räknar pH, är det väl alltid oxoniumjonerna man utgår ifrån? Alltså om nu scenariot var att NaOH är 0.2 mol/dm3 och HCl 0.2 mol/dm3, samt att förhållandet ligger 2:1 - skulle man då vara tvungen att beräkna pOH ( 14 - pOH ) för att ta reda på pH, då NaOH ligger i underskott? Hoppas jag inte ställer alt för många frågor nu…)
Helt korrekt. Ställ så många frågor du behöver!
Tack för svaren! Nu förstår jag 😊



