Pi- och sigmabindningar
Hej,
Denna bild används i en Powerpoint för att förklara skillnaden mellan en pi- och sigmabindning. Dets sägs att elektronerna i den högersta figuren inte är symmetrisk runt bidningsaxeln och har därmed låst rotation. Det jag till att börja med undrar över är om det finns en systematisk namngivning kring x,y och z, eller om man har valt dem slumpartat för att särksilja dem. På bilden ser vi t.ex att 2pz-orbitalerna är symemtriska kring x-axlen, och inte z. Samma gäller för 2px, som sträcker sig över y-axlen och inte x.
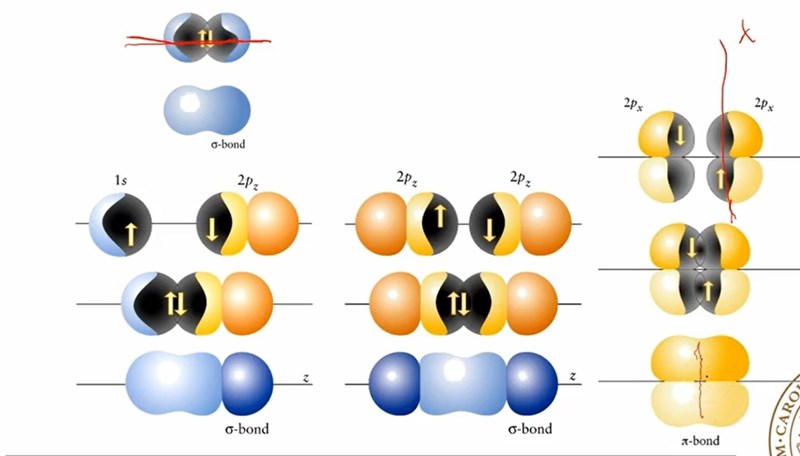
Varför jag är angelägen om att få svar på detta är för att jag har svårt att förstå varför inte även px- och pz-orbitalen som de visas i bilden nedan skulle vara symmetriska runt bidningsaxeln och därmed låsa rotationen dem också.

Tacksam för hjälp!
Alla p-orbitaler är formade ungefär som en hantel. 2px-orbitalen är så orienterad att x-axeln sammanfaller med hantelns handtag, och motsvarande för y och z. Ena änden av handeln har en Schrödingerekvation som är positiv, den andra negativ. Om vi placerar två stycken 2px-orbitaler (från två olika atomer) så att deras positiva ändar sammanfaller, kommer det att bli en bindning. Samtidigt kan man placera y- och z-orbitalerna så att plus och minus stämmer, d v s det bildas ytterligare bindningar. Är du med?
Smaragdalena skrev:Alla p-orbitaler är formade ungefär som en hantel. 2px-orbitalen är så orienterad att x-axeln sammanfaller med hantelns handtag, och motsvarande för y och z. Ena änden av handeln har en Schrödingerekvation som är positiv, den andra negativ. Om vi placerar två stycken 2px-orbitaler (från två olika atomer) så att deras positiva ändar sammanfaller, kommer det att bli en bindning. Samtidigt kan man placera y- och z-orbitalerna så att plus och minus stämmer, d v s det bildas ytterligare bindningar. Är du med?
Ja!
Om du nu roterar den ena atomer runt x-axeln, så kommer x-orbitalerna fortfarande överlappa varandra, men y- och z-orbitalerna kommer att glida från varandra, så det blir en svagare bindning. Om du vrider 1/4 varv så kommer y-orbitalerna att överlappa med z-orbitalerna, och det blir ingen bindning alls. Om du vrider 1/2 varv så kommer + från den ena atomer att överlappa meb - från den andra, och det blir ett par antibindande molekylorbitaler.
Smaragdalena skrev:Om du nu roterar den ena atomer runt x-axeln, så kommer x-orbitalerna fortfarande överlappa varandra, men y- och z-orbitalerna kommer att glida från varandra, så det blir en svagare bindning. Om du vrider 1/4 varv så kommer y-orbitalerna att överlappa med z-orbitalerna, och det blir ingen bindning alls. Om du vrider 1/2 varv så kommer + från den ena atomer att överlappa meb - från den andra, och det blir ett par antibindande molekylorbitaler.
Om det är de svarta figurerna du utgår från (bild nr 2) så undrar jag varför det inte blir någon bindning om man vrider y-orbitalen ett 1/4. Tänk att du ställer y-orbitalen i linje med z-orbitalen. Då möts respketives handtag och en bidning bildas. Jag är dock med på att det inte blir ngon bidning man vrider y-prbitalen ett halvt varv (dvs. låta den fortsätta se ut som den redan gör. Den krockar ju då med z-orbitalen.
En y- orbital kan bara binda till en annan y-orbital, inte till en z-orbital.
Smaragdalena skrev:Om du nu roterar den ena atomer runt x-axeln, så kommer x-orbitalerna fortfarande överlappa varandra, men y- och z-orbitalerna kommer att glida från varandra, så det blir en svagare bindning.
Hur kan du se att att y-orbitalerna kommer glida ifrån varandra om man roterar atomen runt x-axlen?
Sätt ihop dina händer med handflatorna mot varandra. Låt tummarna peka ut vinkelrätt mot de andra fingrarna. Låt pekfingrarna på båda händrena peke uppåt. Då sammanfaller tummarna med varandra och fingrarna med varandra, eller hur?
Låt vänster hand vara kvar, och vrid höger hand så att det är tummen som pekar uppåt. Då "stämmer" varken tummarna eller fingrarna. Är du med på liknelsen?
Ja, på ett ungefär. Jag behöver tänka mer men tack för hjälpen!
Hoppas det märks att jag tycker det är kul med orbitaler!


