Räkna ut mängd syra för visst pH värde
Jag går nu på gymnasiet och ska göra en labb till gymnasiearbetet där jag ska ha utspädda syror i bestämda pH värden (i vatten), och jag använder både starka och svaga syror. Problemet är att räkna ut hur mycket syra jag måste hälla in i något för att få ett specifikt pH värde. Exempelvis om jag ska räkna ut hur mycket ättiksyra jag måste hälla in i en bägare med 0,5L vatten för att få fram en lösning på pH 5. (ska sedan ta 75mL från denna bägare för att hälla in i en plastmugg där jag ska ha en smörgåskrasseodling). Har testat många olika uträkningar som tar flera papper men problemet är att alla leder fram till olika resultat och jag är inte säker på vilken som är rätt. All hjälp uppskattas
Har ni gått igenom syrakonstanten Ka? Om ni inte har det, har jag inte någon bättre idé än att ha en pH-meter och droppa i ättiksyra tills pH är lagom.
Ja vi har gått igenom sådant, har haft både kemi 1 och kemi 2. Men jag behöver en teoretisk uträkning att skriva i labbrapporten till gymnasiearbetet
Du vet vilket pH du skall ha, så du kan beräkna oxoniumjonkoncentratiionen. Jag kallar det värdet H. Koncentrationen av acetatjoner är lika stor. Om koncentrationen av ättiksyra före jämvikt var A, så är jämviktskoncentrationen A-H. Sätt in i uttrycket för Ka och beräkna A.
Du bör ha gjort likadana uppgifter på kapitlet om syrabasjämvikter.
Du har alltså jämviktsekvationen
Man kan skriva om det hela till en andragradsekvation på formen x^2+px+q=0 och sen använda pq-formeln för att bestämma x. Du kommer då få en negativ och en positiv lösning, men eftersom en koncentration aldrig kan vara <0 går den negativa lösningen att ignorera.
Ekvationen ovan kan du använda för att bestämma pH i en vattenlösning av en svag enprotonig syra med koncentrationen [HA]tot mol/dm3 och syrakonstanten Ka. Det går även att rita in den som en kurva där du har koncentrationen på x-axeln och pH på y-axeln eller något liknande.
Är det där ett riktigt exempel eller något du bara drog till med? Jag har inte räknat igenom noga, men är inte pH 5 lite för högt för att det ska funka bra att få det med ättikssyra?
SvanteR skrev :Är det där ett riktigt exempel eller något du bara drog till med? Jag har inte räknat igenom noga, men är inte pH 5 lite för högt för att det ska funka bra att få det med ättikssyra?
Varför det? Du kan komma hur nära pH = 7 du vill, bara du tillsätter tillräckligt lite ättiksyra. Om det är ett smart val är en annan fråga.
Teraeagle skrev :Du har alltså jämviktsekvationen
Man kan skriva om det hela till en andragradsekvation på formen x^2+px+q=0 och sen använda pq-formeln för att bestämma x. Du kommer då få en negativ och en positiv lösning, men eftersom en koncentration aldrig kan vara <0 går den negativa lösningen att ignorera.
Ekvationen ovan kan du använda för att bestämma pH i en vattenlösning av en svag enprotonig syra med koncentrationen [HA]tot mol/dm3 och syrakonstanten Ka. Det går även att rita in den som en kurva där du har koncentrationen på x-axeln och pH på y-axeln eller något liknande.
Eftersom vi vet pH är det där onödigt krångligt. Vi får att
där vi vet att . Lös för A.
Smaragdalena skrev :Eftersom vi vet pH är det där onödigt krångligt. Vi får att
där vi vet att . Lös för A.
Jag tolkar @ripgyarbete som att det ska göras flera lösningar med olika pH-värden och syror.
ripgyarbete skrev :
Exempelvis om jag ska räkna ut hur mycket ättiksyra jag måste hälla in i en bägare med 0,5L vatten för att få fram en lösning på pH 5.
Smaragdalena skrev :SvanteR skrev :Är det där ett riktigt exempel eller något du bara drog till med? Jag har inte räknat igenom noga, men är inte pH 5 lite för högt för att det ska funka bra att få det med ättikssyra?
Varför det? Du kan komma hur nära pH = 7 du vill, bara du tillsätter tillräckligt lite ättiksyra. Om det är ett smart val är en annan fråga.
Det måste vara väldigt svårt att få tillräcklig precision i koncentrationen för att pricka pH 5. Se grafen nedan (ättiksyrans koncentration på x-axeln, pH-värdet på y-axeln):
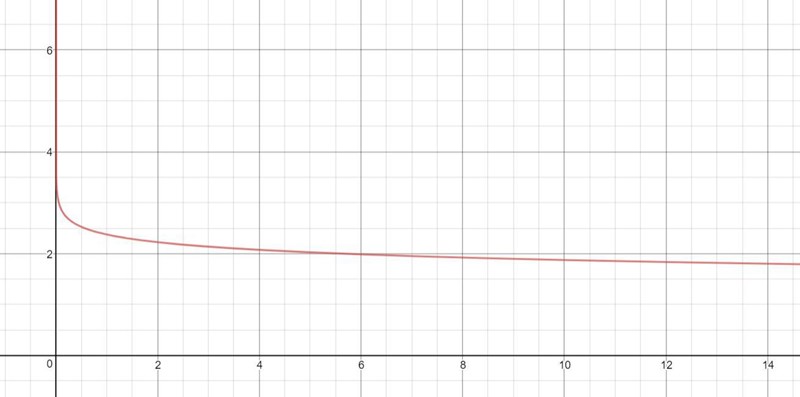
På så sätt har @SvanteR rätt i att det inte lär fungera särskilt bra, även om det är teoretiskt möjligt.
Så för att summarisera ska jag ersätta X i den ekvationen med 10^-pH och sedan lösa ut A? Men vad blir då A, är det koncentrationen syra jag ska ha i min lösning? Och isåfall hur räknar jag ut hur mycket syra jag ska hälla in utifrån det värdet? Jag vet inte vad jag ska göra med koncentrationsvärdet, vill bara veta hur mycket jag faktiskt ska hälla in utav en syra för att få ett bestämt pH :L
Jag behöver en formel för starka syror också dock, använder HCl och HNO3 också.
Längesedan vi hade uträkningar med jämvikt och jag kommer knappast ihåg något.
ripgyarbete skrev :Så för att summarisera ska jag ersätta X i den ekvationen med 10^-pH och sedan lösa ut A? Men vad blir då A, är det koncentrationen syra jag ska ha i min lösning? Och isåfall hur räknar jag ut hur mycket syra jag ska hälla in utifrån det värdet? Jag vet inte vad jag ska göra med koncentrationsvärdet, vill bara veta hur mycket jag faktiskt ska hälla in utav en syra för att få ett bestämt pH :L
Jag behöver en formel för starka syror också dock, använder HCl och HNO3 också.
Längesedan vi hade uträkningar med jämvikt och jag kommer knappast ihåg något.
Det kan vara bra med ett klargörande kring hur många lösningar och (svaga) syror som du ska använda. Är det bara en lösning med ättiksyra och pH 5?
För starka syror gäller helt enkelt sambandet
[H+] är samma sak som syrans koncentration så länge syran är enprotonig (vilket är fallet för både HCl och HNO3).
Jag ska använda HNO3 HCl och ättikssyra. Dessa ska jag sedan blanda in i lösningar för att få alla pH från 2, 2.5, 3.... fram tills 6.5 ifall möjligt d.v.s. halvsteg från 2 till högsta möjliga under 7. Varje syra blandas in i en lösning med endast kranvatten och den syran. Min skola har mikropipetter (kan mäta lösningar i hela mikroliter) så det kanske inte borde vara några större problem att skapa koncentrationer ifall jag bara helt enkelt ökar mängden vatten på lösningen som jag ska blanda syran i, och sedan bara ta 75mL från den lösningen för att göra laborationen med. Problemet var bara uträkningarna.
Starka syror försökte jag räkna ut såhär m.h.a teraegla: H+ = 10^-pH och sedan använde jag H+ som C2 i formeln C1*V1 = C2*V2 för att lösa ut V1 (mängden syra som ska hällas in) där C1 är syrans originalkoncentration och V2 är volymen på lösningen, detta fall 0,075L. Är det rätt?
För att ge bättre svar skulle det underlätta om vi fick veta upplägget på gymnasiearbetet.
Det jag tycker skulle kännas mest naturligt vore att göra buffertlösningar med samma sorts buffert med olika pH (men det går knappast att ha samma buffert för ett så stort pH-intervall) och sedan tillsätta nitratjoner eller kloridjoner, om det är dem man är ute efter.
Det borde vara ännu svårare att pricka rätt pH med de starka syrorna än med ättiksyra.



