räkna ut masshalten..
hej, detta är frågan; 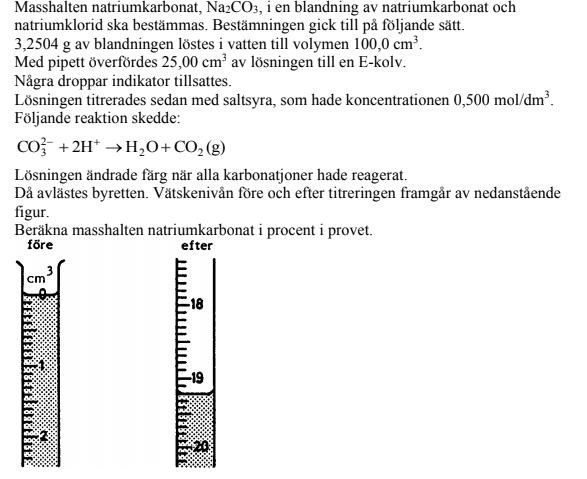
jag är inte säker på hur man gör.
Hejsan hejsan,
Kan du visa hur du har försökt?
jo asså jag tror jag är helt borta men jag gjorde 0.5 x 100? för att få substansmängden och det blev 50. Hur ska jag fortsätta?
eller nej det va 100 cm3 så substansmängden ska vara 0,5 x 0,1 = 0,05
Kan du visa alla dina uträkningar på ett svar?
det där är allt jag har gjort sålänge tyvärr, därför behöver jag hjälp
0,5 x 0,1 = 0,05 mol
är det fel substansmängd?
- Det står i frågan att du löste 3.2504 g natriumkarbonat i 100 mL vatten, hur många mol har du då?
- Av dessa 100 mL så tar du 25 mL - hur många mol finns det då i den lösningen?
- Du titrerar dessa mol karbonatjoner med 0.500M saltsyra. Kan du utläsa hur många mL du har tillsatt för att nå ekvivalenspunkten?
- Vad är molförhållandet mellan karbonatjonerna och vätejonerna? Dvs. från detta vet du hur många mol natriumkarbonat du hade i lösningen.
0,03 mol i första? Jag tog molmassan och dividerade massan med det.
jag fick 0,78125 som molförhållande. vad gör jag nu snabbt
Börja om från början. Du vet ju att det inte är rent natriumkarbonat, så det är meningslöst att räkna ut hur många mol det är.
Första steget är att läsa av volymen titrator. Hur många milliliter saltsyra har man använt?



