Räkna ut tryck i en påse - ideala gaslagen
Hej! Jag ska räkna ut trycket i en påse som rullas ihop som ni ser nedan. Jag är dock orolig att jag inte satt in rätt värden så jag inte är van vid att räkna med mol och gaskonstanter etc... Kan någon se över värdena och säga om jag tänkt rätt?

Tack på förhand!
I fråba b) nämns det att temperaturen värms från 22 °C till 34 °C så antar att jag skulle utgått från 22 °C och inte rumstemperatur (20 °C) som jag först trott. Eller innebär detta att temperaturen var irrelevant i a)?
Du har ideala gaslagen pV = nRT. I a-uppgiften ändras varken substansmängden luft (n), gaskonstanten R (naturligtvis) eller T. Det gäller alltså att p1V1 = p2V2, och att V2 = V1/2. Du vet alltså att .
EDIT: Sista ekvationen skall vara
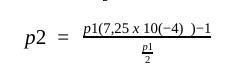
Så det ända värdet jag kan sätta in här är V eller hur?
Hur funkar det sedan med p1 och p2? Hur kan jag lösa ekvationen? Har inte erfarenhet med att dela med ett redan delat värde som i denna ekvation.
Tack så jättemycket för hjälp!
Jag skrive fel i mitt förra inlägg. Det skall vara , vi vet ju att den nya volymen är hälften av den gamla. Föreklar vi lite blir det .
Smaragdalena skrev:Jag skrive fel i mitt förra inlägg. Det skall vara , vi vet ju att den nya volymen är hälften av den gamla. Föreklar vi lite blir det .

Har jag gjort rätt då?
Fortsatte sedan på b) men fick ett mycket orimligt svar, vad har jag gjort fel? Tack! :)
 Volymen från början är ju 1,45 l, så svaret kan ju inte stämma...
Volymen från början är ju 1,45 l, så svaret kan ju inte stämma...
Varifrån har du fått molmassan 28,949 g/mol för chips?
Använd dig av att . Trycket är konstant och substansmängden är konstant så ekvationen förenklas till så .
Smaragdalena skrev:Varifrån har du fått molmassan 28,949 g/mol för chips?
Använd dig av att . Trycket är konstant och substansmängden är konstant så ekvationen förenklas till så .
Hej! Molmassan hittade jag på internet för luft :S Men misstänkte att något var galet, vet heller inte hur man använder molmassa i en ekvation...
Ska temperaturen fortfarande vara i Kelvin och volymen i m3? För nu känns mitt svar mycket orimligt:
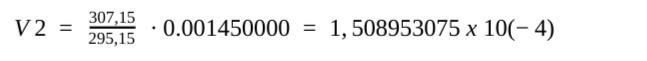
Eftersom du bara multiplicerar volymen med en konstant, kan du lika gärna sätta in volymen i enheten liter. V2 = (307/295)*1,45 liter = 1,51 liter ungefär.


