Redoxreaktion

Hej jag har försökt lösa denna uppgift med OT-metoden men det tycks inte ge sig.
På a) om jag börjar med att skriva upp formeln och sätter ut alla OT ser jag att Zn avger 2 e - och N tar upp 4. Därför sätter jag 4 Zn och 2 HNO3. Då blir skillnaden i laddning mellan reaktanterna och produkterna 8+ på "produktsidan" vilket gör att jag sätter ut 8 H+ extra på höger sida vilket ger 10 H+ och därmed blir det 5 H2O på produktsidan, MEN syret balanseras inte när jag kontrollerar och jag kan inte komma på hur jag ska göra.
Tacksam för hjälp!
Har du glömt att det är en syreatom i lustgasen?
Smaragdalena skrev:Har du glömt att det är en syreatom i lustgasen?
Problemet är att jag har 7 stycken syreatomer bland produkterna och 6 bland resultanterna.
Umely skrev:Smaragdalena skrev:Har du glömt att det är en syreatom i lustgasen?
Problemet är att jag har 7 stycken syreatomer bland produkterna och 6 bland resultanterna.
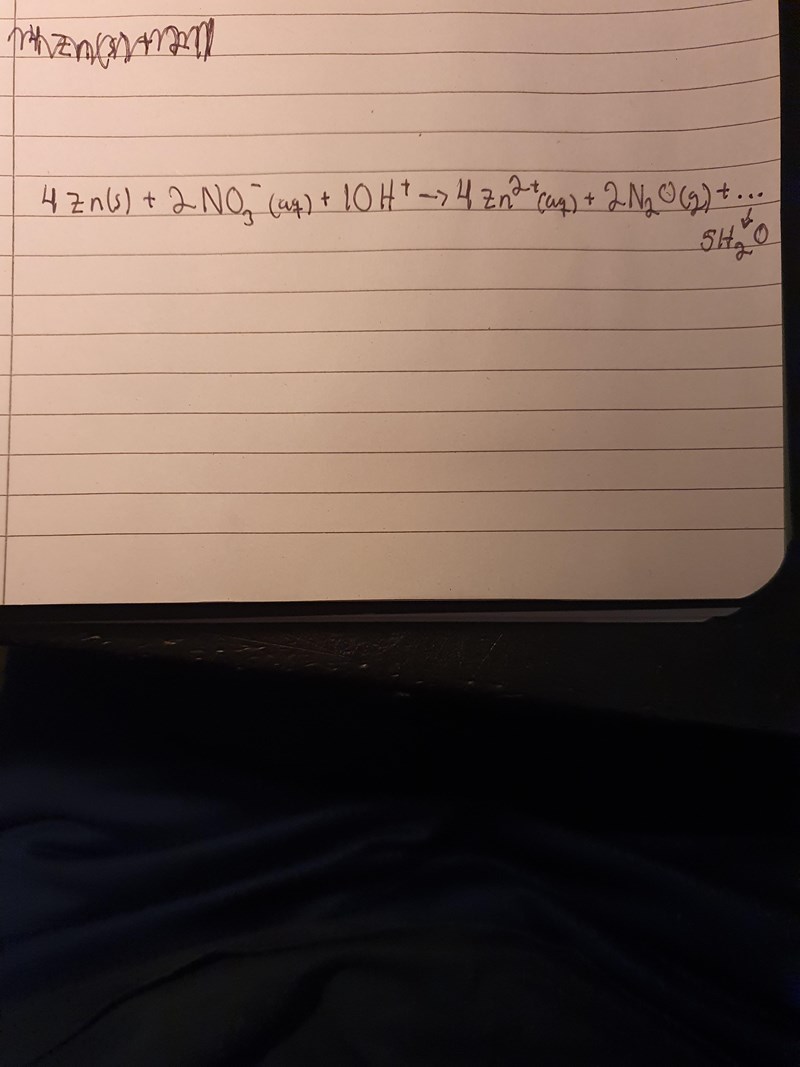
Det blir bara 1 N2O.
Tack! Det är så klart det blir så. Uppskattar verkligen hjälpen!


