Redoxreaktioner - Vilken gas framställs?
Hej!
Vi jobbar med redoxreaktioner på kemin och har en fråga som jag inte kunnat hitta ett ordentligt svar på.
Frågan är föjande:
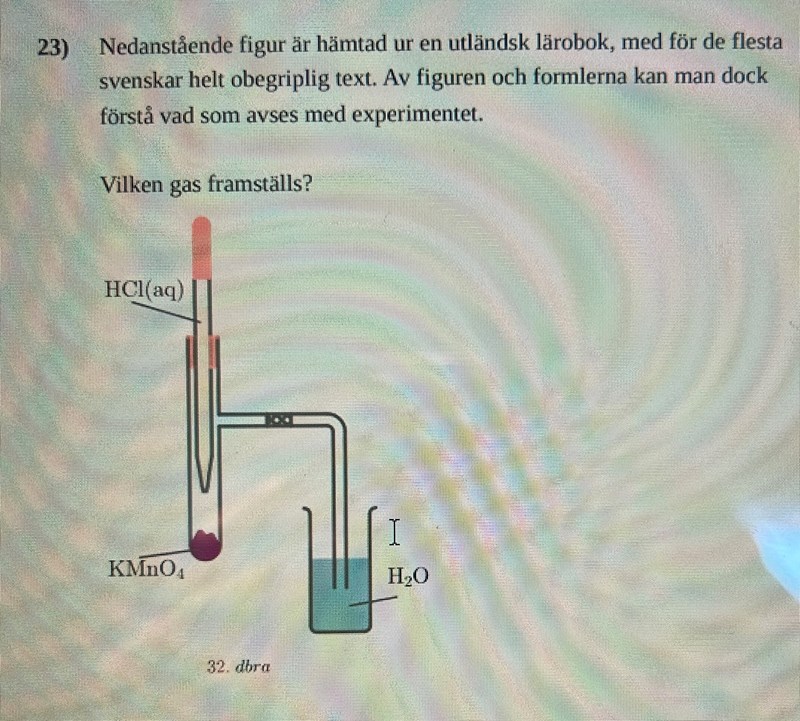 Jag har förstått att metaller och halogener gärna binder sig med varandra. I reaktionen har vi halogenen klor (Cl) och metallerna kalium (K) och mangan (Mn). En av produkterna ska också vara vatten.
Jag har förstått att metaller och halogener gärna binder sig med varandra. I reaktionen har vi halogenen klor (Cl) och metallerna kalium (K) och mangan (Mn). En av produkterna ska också vara vatten.
Däremot har jag svårt att förstå hur jag ska kunna koppla ihop ämnena och veta vilka produkter som framställs. Det är inget vi har gått igenom och jag kan inte hitta någon bra källa på internet. Jag har också tittat på facit för att få vägledning men fick inte ut något av det.
Jag tänker att det kanske har med oxidationstalen att göra men kommer inte riktigt vidare.
Tack på förhand!
Manganet i permanganatjoner har ett mycket högt oxidationstal, d v s de reduceras lätt. Då behöver något annat oxideras. Det som kan oxideras i saltsyra är antingen vatten, oxoniumjoner eller kloridjoner. Vilket av dessa är lättast att oxidera? Kolla i en normalpotentialtabell!
Jag vet att ju lägre normalpotential, desto starkare reduktionsmedel. Starka reduktionsmedel oxideras lätt så därför borde den som oxideras lättast ha lägst normalpotential.
Jag hittade i en normalpotential tabell att e0 för kloridjonerna är +1.36 och att e0 för vatten är -0.83 eller +1.23, jag vet inte riktigt vilken av de jag ska kolla på. Jag kunde däremot inte hitta e0 för oxoniumjonerna. Finns det en specifik regel för det?
Att e0 för reaktionsn 2 H+ + 2e- => H2 är själva nollpunkten för hela normalpotentialtabellen.
Så oxoniumjonerna har e0 0 men eftersom att vatten har -0.83 kommer det oxideras lättast.
Hur kan jag fortsätta då?
Vad menar du att vattnet oxideras till?
Min lärare har inte lärt oss hur man läser av en normalpotential tabell så jag kanske gjorde fel. Jag tittade på H2 som oxideras till 2H2O. Förlåt för förvirringen!
Jag tror jag råkade läsa tvärtom när vatten är reducerad. Istället tror jag det blir att 2H2O med e0 +1.23 oxideras till O2 + 4H+ + 4e-.
Men om vatten har +1.23 är det väl inte vattnet som oxideras?
Jag löste den! Tack för hjälpen.



