Redoxtitrering
Hej har fastnat på en svår uppgift.
117 dm3 svavelvätehaltig luft fick passera ("bubbla" igenom) 140 cm3 jodlösning vars I2 koncentration var 0,109 mol/dm3. Under passagen reagerade svavelvätet med jod under bildning av fritt svavel och jodidjoner. Den jod som därefter återstod i lösningen titrerades med natriumtiosulfatlösning. Det gick åt 21,30 cm3 av Na2S2O3 lösningen vars koncentration var 0,1950 mol/dm3. Hur många volymprocent H2S innehöll luften? Du kan räkna med att mol volymen för H2S var 24,8 dm3/mol.
jag vet inte ens hur man ska börja.
Har börjat med att balansera formeln.  Vet dock inte hur jag ska göra i slutet. Tänkte att jag delar 1,775*10^-3 med 24,8 men får ej rätt svar
Vet dock inte hur jag ska göra i slutet. Tänkte att jag delar 1,775*10^-3 med 24,8 men får ej rätt svar
Bra början att balansera formeln! Du har en reaktionsformel till som behöver balanseras. (Oj, den fanns redan, nedanför pennan.)
Från början hade man en lösning med volymen 140 cm3 av jod med koncentrationen 0,109 mol/dm3. Man lät luft som innehöll svavelsväte bubbla genom lösningen, så att en del av joden reagerade och bildade jodidjoner. Efteråt lät man lösningen reagera med tiosulfatlösnikng, så att resten av joden reagerade.
Hur många mol jod fanns det i den ursprungliga lösningen?
Hur många mol jod fanns det i den "reagerade" lösningen?
Hur många mol jod hade förbrukats?
Hur många mol vätesulfid motsvarar detta?
Vilken volym% motsvarar detta?
Du har gjort fel när du har balanserat formlerna.
I första formeln bildas vätejoner, inte vätgas.
I andra formeln är det jod som reagerar, inte jodidjoner.
Oj, jag la inte märke till att du hade skrivit reaktionsformlerna fel respektive baklänges. Bra att Teraeagle har ögonen med sig!
Teraeagle skrev:Du har gjort fel när du har balanserat formlerna.
I första formeln bildas vätejoner, inte vätgas.
I andra formeln är det jod som reagerar, inte jodidjoner.
 Kändes som att de va något som var fel! Är det rätt nu?:)
Kändes som att de va något som var fel! Är det rätt nu?:)
Smaragdalena skrev:Bra början att balansera formeln! Du har en reaktionsformel till som behöver balanseras. (Oj, den fanns redan, nedanför pennan.)
Från början hade man en lösning med volymen 140 cm3 av jod med koncentrationen 0,109 mol/dm3. Man lät luft som innehöll svavelsväte bubbla genom lösningen, så att en del av joden reagerade och bildade jodidjoner. Efteråt lät man lösningen reagera med tiosulfatlösnikng, så att resten av joden reagerade.
Hur många mol jod fanns det i den ursprungliga lösningen?
Hur många mol jod fanns det i den "reagerade" lösningen?
Hur många mol jod hade förbrukats?
Hur många mol vätesulfid motsvarar detta?
Vilken volym% motsvarar detta?
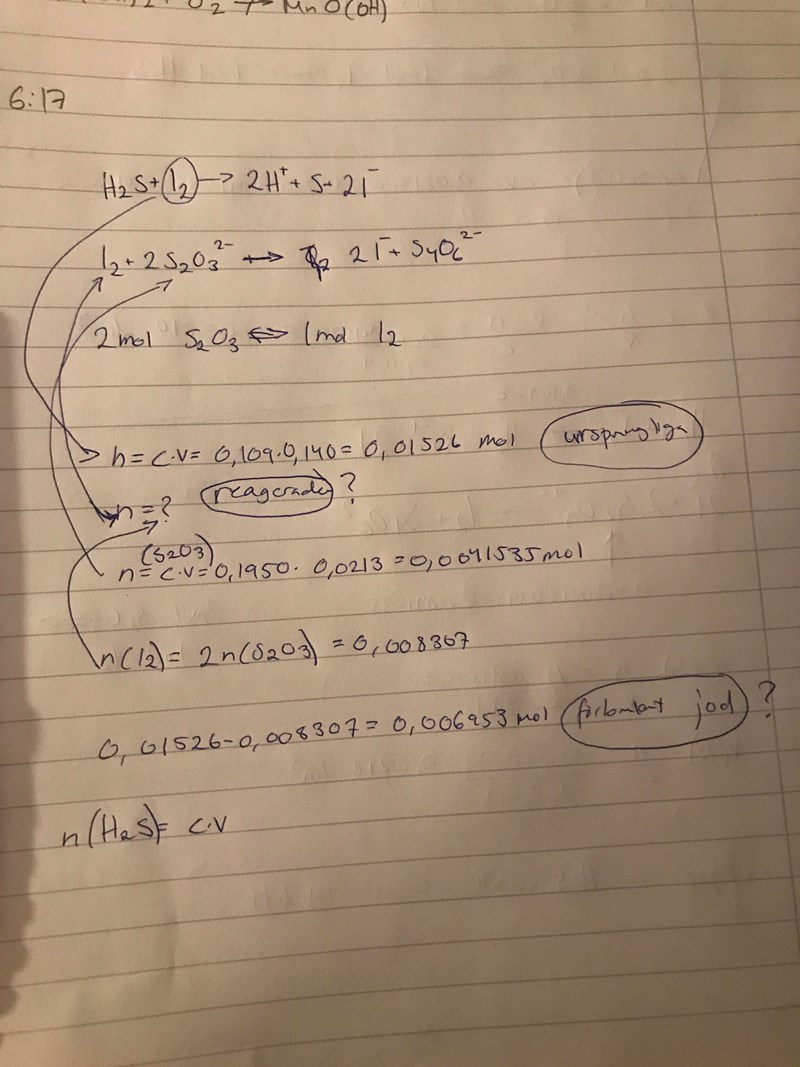 Är jag på rätt väg? Tror jag tagit fel på den förbrukade joden? Jag är jätteförvirrad när det kommer till detta
Är jag på rätt väg? Tror jag tagit fel på den förbrukade joden? Jag är jätteförvirrad när det kommer till detta
Det var ett makalöst kladdigt papper. Tror du inte att du förstår bättre om du skriver om det en gång till, snyggt och prydligt?
Få se... Unsprunglig substansmängd av jod - 0,015 mol (orkar inte fler värdesiffror). Förbrukad mängd tiosulfatmängd - 0,008 mol. Nej, substansmängden av jod är hälften av substansmängden tiosulfat, inte dubbla. Detta är den jod som inte har reagerat med svavelvätet i den första reaktionen. Det som har reagerat med svavelvätet var alltså 0,015-0,004 = 0,011 mol.
Hur skall du fortsätta sedan?
Jag är jätteförvirrad när det kommer till detta
Varför? Kan du förklara detta, tror jag du är en bra bit på väg mot att inte vara förvirrad längre.



