Resonansstabilisering
hej,
varför släpper H+ i sin bindning och "försvinner"
jag förstår inte det allra första steget.
Har svårt för att förstå resonansstabilisering
Jag har inte heller så bra koll. Gissningsvis har fenolatjonen lägre energi och är stabilare när den protolyserats och släppt en proton.
Hittade precis den här uppgiften (2 min in): https://m.youtube.com/watch?v=qhy6SiuPQN8
Kika!
Resonansstabilisering är något som hör till valensbildningsteorin och är mera en beräkningsmetod. Ju fler resonansstrukturer du kan rita desto stabilare är ämnet.
I molekylorbitalsteorin förklarar man stabiliteten med extra interaktionen mellan delokaliserade elektroner i bensenringen och syrets fira elektronpar, ungefär så här:
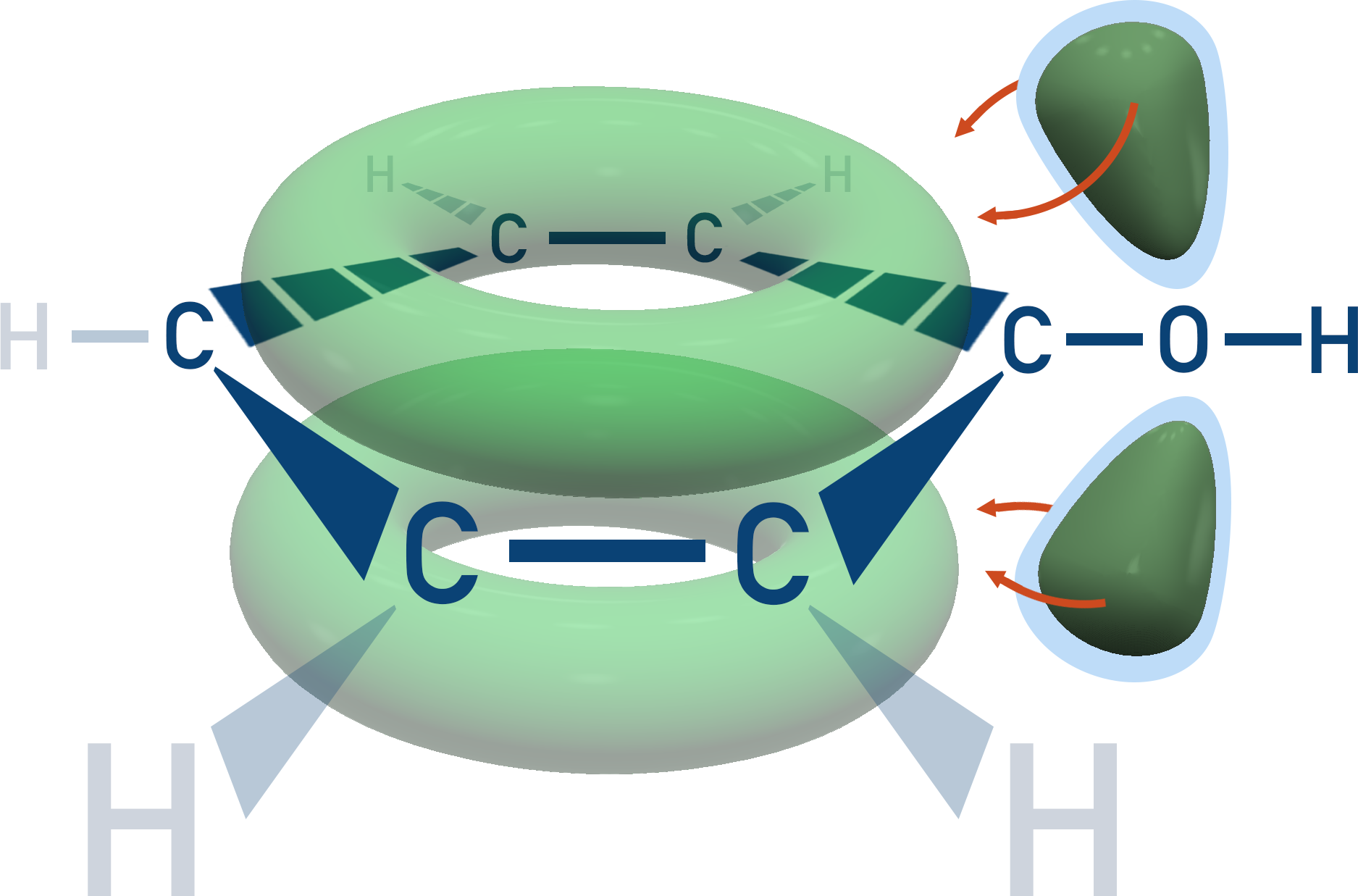
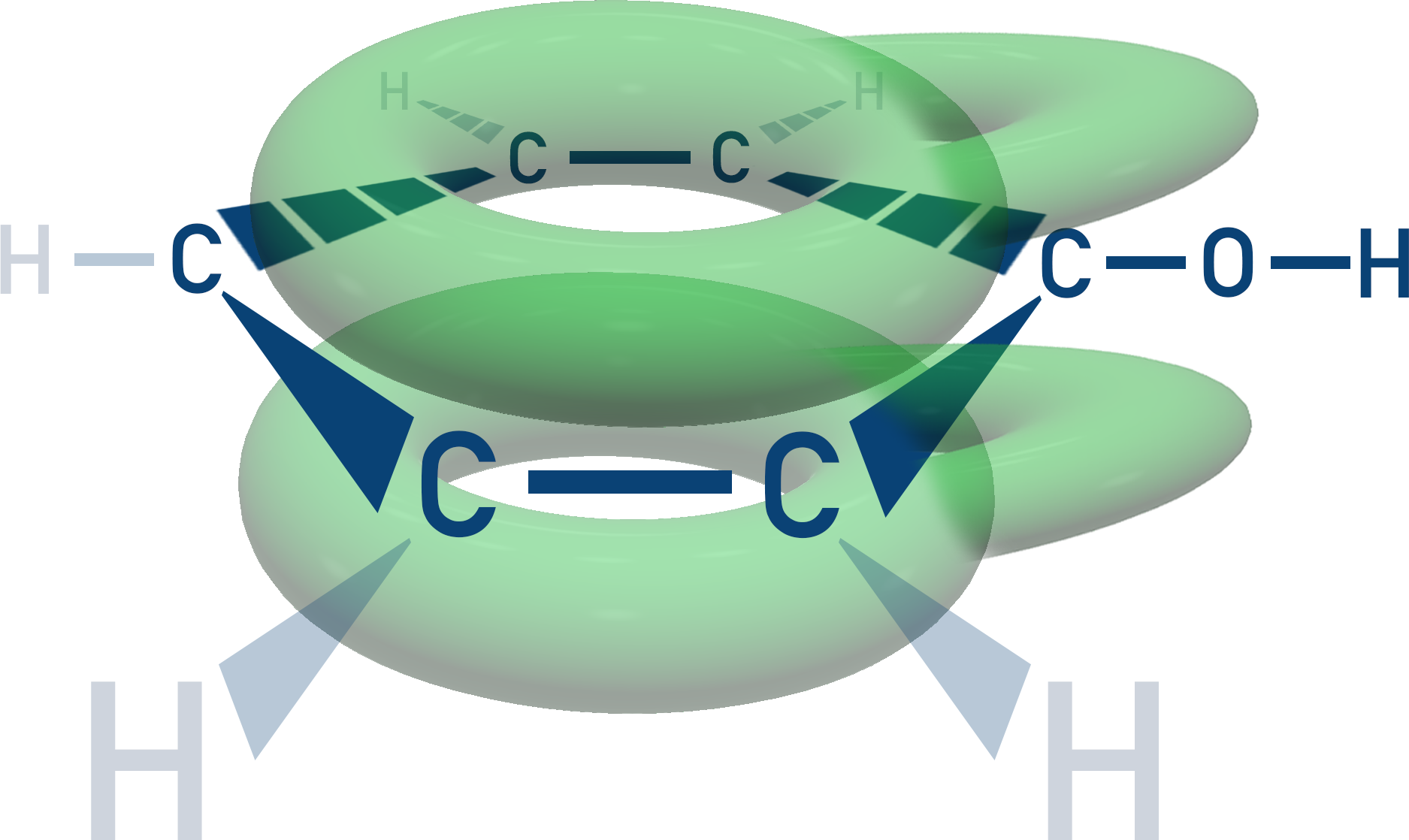
Det gör att den negativa laddningen kan spridas över fler atomer och fenolanjonen blir stabilare.


