Respons om labbrapport
Reaktionshastighet
1.1 Syftet
Syftet med laborationen är att bestämma reaktionshastigheten för hur oxalsyrans reagens med permanganatjoner påverkas av temperatur och koncentrationsförändring.
Hypotes:
Eftersom temperatur är ett viktig faktor för att driva reaktionshastigheten kommer provrör F att visa vit färg fortast.
1.2 Teori
En reaktionshastighet är hastigheten på hur fort en reaktion sker och mäts i mol·dm-3.Reaktionshastigheten ökar om koncentrationerna ökar. Det finns då större chans till kollisioner/krock mellan partiklar eftersom antalet reagerande partiklar (atomer, joner eller molekyler) är större när de så småningom träffar varandra så innebär det att reaktanterna har tillräcklig hög energi för att reagera med varandra. Reaktionshastigheten ökar också om temperaturen höjs. Det beror på att partiklarna i ämnet rör sig fortare då och chansen att de krockar blir större. En katalysator är ett ämne som höjer reaktionshastigheten utan att den själv förbrukas eftersom katalysatorn möjliggör en reaktionsväg som har lägre aktiveringsenergi än reaktionen utan katalysator. I en reaktion mellan två ämnen som är i olika aggregationstillstånd, exempelvis ett fast ämne (metall) och en vätska (syra), ökar reaktionshastigheten också om kontaktytan ökar det vill säga att metallen får reagera i pulverform.
1.3 utförande
Första så förbereddes två vattenbad med temperaturen ca 30 grader celsius och temperaturen 40 grader celsius. Därefter placerades 6 stora provrör på borden märkta från A till F. Dessa fylldes med lösningar enligt blandning schemat :
Därefter värmdes provrören E och F i vatten baden, E till 30 graders celsius och F till 40 graders celsius.
Efter ha tillsatt E och F i vatten baden , så tillsättas det kaliumpermanganatlösning (KMnO4) till provrören i ordning , ett i taget. Direkt efter tillsatsen omskakades provröret så att lösningen blandades , därefter ställdes provröret på borden tills vit bakgrund erhålls.Tiden mättes från start (när kaliumpermanganat hälldes i provrören) tills det förblev helt färglös.Observera att på bägare D tillsattes även mangansulfat (MnSO4). Följande tillsatser skedde:
A: 1 ml KMnO4
B: 2 ml KMnO4
C: 4 ml KMnO4
D: En knivsudd MnSO4 sedan 1 ml KMnO4
E: 1 ml KMnO4
F: 1 ml KMnO4
1.4 Resultat
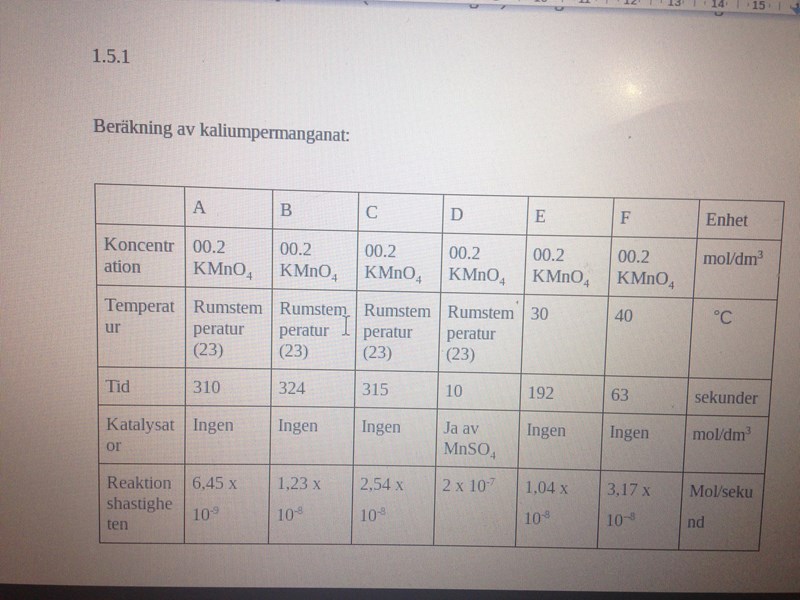
Det åtgick 2 x 10-7 Mol per sekund för bägare D att visa vit bakgrund.
Reaktionshastigheten uttryckt som mol per sekund av kaliumpermanganat samt MnSO4 i bägare D :
A
B
C
D
E
F
6.45 x 10-9
1.23 x 10-8
2.54 x 10-8
2 x 10-7
1.04 x 10-8
3.17 x 10--8
Mol/sekund
1.5 Diskussion
Det tycks som att hypotesen har falsifieras - det gick åt 10 sekunder för bägare D att visa vit färg medan bägare F dröjde det ytterligare 53 sekunder för att visa vit bakgrund. Det betyder att skillnaden var för stor vilket inte ligger nära felmarginalet för experimentet.Hypotesen utgick med att provrör F skulle visa vit färg innan de fem andra bägare A,B,C,D,E eftersom vatten baden innehöll 40 graders värme vilket innebar att energin av partiklarna skulle öka eftersom det var hög temperatur vilket skulle leda till högre hastighet. Eftersom 2 x 10-7 Mol/sekund åtgick för att visa vit färg så är skillnaden i sekunder mellan provrör D och F mer än fem ggr. Om hypotesen varit korrekt så borde temperaturen ha mer påverkan att sätta igång reaktionen mycket fortare än provrör D som hade innehöll ett katalysator.Den totala substansmängden för alla provrör är 0.002 mol.MnSO4
som är katalysatorn för provrör D har större påverkan att sätta igång ett reaktion än vad provrör F gjorde.
Vattenmolekylerna som var i ständig rörelse i varje provrör attackerade kaliumpermanganat , de kolliderade med partiklarna hos kaliumpermanganat och förde över rörelseenergi till dem. Kaliumpermanganetlsöningen det vill säga oxalsyran och permangatjonerna blev längre inte låsta i sina positioner vilket gjorde att de blev fria och började vandra ut i vattnet.Där kolliderar de dem med andra molekyler och joner när oxalsyran och pernamgantjonerna stötte eller rättare sagt krockade ihop förblev det en kemisk reaktion som kallas för aktiveringsenergin som var den energin som behövs för att och det var det som gjorde att det vita färgen började erhållas.
När det gällde katalysator katalysatorn tillsattes vid bägare D och det kunde tidigare konstateras att katalysatorn gjorde jobbet för vit färg att erhålla än vad temperaturen gjorde i vatten molekylerna .Katalysatorn reagerande själv men öppnade en ny och snabbare väg för kaliumpermanganat att reagera som krävde låg aktivering energi än vad temperaturen gjorde som krävde hög aktiveringsenergi.
1.6 Slutsats
Det åtgick 10 sekunder för bägare D att visa vitfärg eftersom en katalysator har ett mycket lägre aktiveringsenergi än vad temperaturen har och är därmed den snabbaste provrören som visade vit färg.
Hypotesen är obegriplig, eftersom man inte har någon aning om vad som skiljer provrör F förån de övriga. Att lösnigen blir färglös betyder inte att den blir vit.
1.2 Enheten för reaktionshastighet är fel (det du har skrivit är koncentration). det fattas något i sista meningen i första stycket. Det verkar som om du har rört ihop vad som ändras vid ökande koncentration eller ökande temperatur (tror jag,det är otydligt skrivet).
Chansen för att två partiklar ökar inte för att hastigheten ökar, däremot ökar sannolikheten att de har tillräckligt stor energi för att det skall ske en reaktion.
1.3 Du behöver inte värma vattenbaden två ggr till samma temperatur. Schemat för vad som finns i varje rör saknas på rätt ställe - sätt det där du skriver att det skall vara eller skriv "enligt nedan". När tillsatte ni oxalsyra? Det står inte att ni gjorde det. Är det någon skillnad mellan rör E och F? Fanns det vatten också i provrören, så att det blev olika koncentrationer i rör A, B och C? Vilken koncetration hade den tillsatta kaliumpermanganatlösningen?
1.4 Vad menar du med att "Det åtgick 2 x 10-7 Mol per sekund för bägare D att visa vit bakgrund"? Resultatet borde vara hur många sekunder det tar för vardera provröret att klarna. Det vore bra med diagram med koncentration på x-axeln och tid på y-axeln (med olika markeringar för olika temperaturer och för tillsatt katalysator). Har ni tagit hänsyn till att det finns 4 ggr mer permanganatjoner i rör C än i rör A? Hur har ni räknat ut reaktionshastigheterna?
1.5 Det var väl bara i rör D det fanns mangansulfat? Ni skriver att samtliga rör innehöll 0,002 mol mangansulfat. I en kaliumpermanganatlösnig finns det inga kaliumpermanganatpartiklar - det är upplöst till kaliumjoner och permanganatjoner.
1.6 samma otydlighet som i hypotesen
Vi satte alldrig oxalsyra , det är vad som hände när kaliumpermangant hälldes i vare provrör att oxalsyran och permenantjonerna kolliderade
Reaktionshastigheten skulle räknas som mol per sekund
Ja, reaktionshastighet räknas i mol/sekund, inte mol per kubikdecimeter.
Hur kunde permanganatjonerna reagera med oxalsyran om ni aldrig tillsatte någon oxalsyra?
Kaliumpermangtet innan den skullle ske så reagerade oxalsyra och permenantjoner och det är det jag antog hände när det vita färgen kom fram , eller var det så eller inte är också osäker. Min fråga är hur skedde det vita färgen ?
Du måste ha tillsatt oxalsyra (eller något annat reduktionsmedel) vid något tillfälle. Det är bl a sådant som skall framgå av en labrapport.
Nej vi tillsatte det aldrig , vi satte bara till kaliumpermanngnat . Men jag undra hur går den lilla färgen dvs kaliumpermangat går bort när den väl reagerar med vatten?
Kaliumpermanganat reagerar inte med vatten, om man inte tillsätter något annat. Leta upp din labbhandledning - du måste ha glömt av något som du faktiskt har gjort.
Juste det tillsattes vatten , svavelsyra och oxalsyra . Men det kommer ta evigheter att fixa labben igen. Tack för hjälpen !
Kan du förklara aktiveringsenergin som hör ihop med labben , får ingen grep?
Många kemiska reaktioner sker på så sätt att två reaktanter krockar med varandra och kopplas ihop till ett s k aktiverat komplex. Detta aktiverade komplex sönderfaller sedan till produkterna. För att de båda reaktanterna skall kunna bilda ett aktiverat komplex krävs det att de har tillräckligt stor energi - annars studsar de bara mot varandra utan att reagera. Hur stor energi reaktanterna har beror på temperaturen - ju högre temperatur desto större energi och därmed större chans att det bildas ett aktiverat komplex (som sedan bildar produkterna). Om jag minns rätt så skall en ökning med 10 grader ge en fördubbling av reaktionshastigheten - stämme rdetmed era beräkningar?
Om man tillsätter en katalysator så öppnas det en ny reaktionsväg - det motsvarar att aktiveringgsenergin (den energi som behövs för att det aktiverade komplexet skall bildas) blir mycket lägre, så en mycket större andel av partiklarna har tillräckligt hög energi för att det ektiverade kompelxet skall kunna bildas, och så bildas produkterna snabbare.
Nu när jag har fixat allt du har kommenterat , innebär det att jag ligger på ett högnivå på just denna labbrapport?
Det kan jag inte svara på. Exempelvis vet jag int ehur uppgiften är formulerad eller vilken mall ni har fått för hur man skriver labrapporter.
Ok , tack för hjälpen!!
Jag glömde fråga , hur skulle du gemföra resultat om du hade gjort resultatet, vill förstå hur det går till?
Det är lite svårt att tyda vad du menar, men framför allt skulle jag redovisa vad det är jag har mätt upp - rimligen tiden det tar för lösningen i varje provrör att avfärgas. Det vore också rimligt att skriva upp reaktionshastigheten i vardera röret (med uträkningar för åtminstone ett exempel).
Jag tror att jag skulle vilja presentera resultaten som en tabell med rörets beteckning, koncentration, temperatur, katalysator eller ej, tid och reaktionshastighet.
Nej jag menar , om du kollar nu på tabellen ovan hur skulle du jämföra varje provrör med resultat var och en fick till exempel som du sa ovan att provrör A och C har samma reaktionshastighet , hur skulle du fortsätta jämföra de andra provrör?
Vilken tabell? Skriv en snygg tabell och lägg in den i ett eget inlägg. Den röran som du har i ditt första inlägg är helt oläsbar.
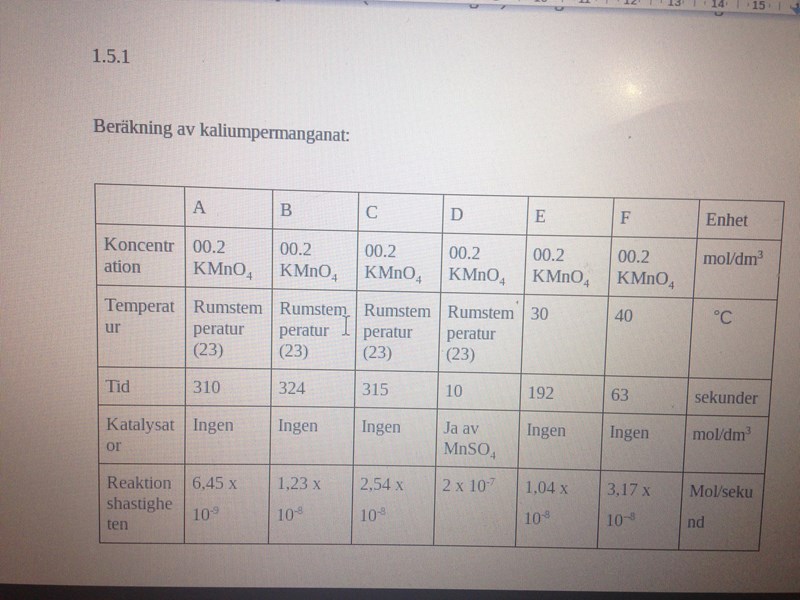
Reaktionshastigheten uttryckt som mol per sekund av kaliumpermanganat (KMnO4) samt magnesiumsulfat (MnSO4) i bägare D :
6,45 x 10-9 A
1,23 x 10-8 B
2,54 x 10-8 C
2 x 10-7 D
1,04 x 10-8 E
3,17 x 10--8 F
Mol/sekund
Kunde inte göra bättre än så , hoppas att det duger.
Nej, jag fattar absolut ingenting av det du skriver.
För det första har du skrivit magnesiumsulfat när du menar mangansulfat.
För att diagrammet skall vara intressant behövs det att man snabbt kan se dels koncentrationen av permanganatjoner och dels reaktionshastigheten, så att man kan se att hastigheten fördubblas när koncentrationen fördubblas.
Någonstans under rubriken resultat bör du ha dina mätvärden, d v s hur lång tid det tog för de olika provrören att avfärgas. Det är den viktigaste delen av resultaten - utan de mätvärdena kan man inte räkna fram reaktionshastigheterna.
Det är också nödvändigt att du skriver om ditt utförande så att det går lätt att se exakt vad du hade i varje provrör. Om någon skulle vilja upprepa ditt experiment, skall den personen veta precis vad det är som skall göras för att kopiera vad du har gjort.
Men hur skulle du resonera kring resultatet?
Det har jag svårt att svara på innan du har presenterat en tabell som jag kan tyda, så att jag kan se tydligt vad som hänt i varje rör och vad det är för skillnad mellan se olika rören.
Det här är resultatet , vi har räknat ut mål och sen delat antalet mol med antalet sekunder det togs att avfärga färgen . Dett är mycket tydligare.

Du måste ändå ha en snygg tabell i din rapport. Det är lika bra att du gör det nu - eller åtminstone lägg in en bild som går att läsa på rätt håll. Vad jag kan se, så måste man veta mycket som jag inte vet för att kunna tyda dina anteckningar. Det skall inte behövas.
Gör en tabell med rörets beteckning, koncentration, temperatur, katalysator eller ej, tid och reaktionshastighet. En rad för varje rör. Fyll i alla tillämpliga rutor.
Jag menar om du kan analysera resultaten jag hade , till exempel så sa du att bägare A är dubbelt så stor som bägare C osv , det är det jag inte får grep på ?
Ser den här tabellen bättre ut och om ja kan du jämföra mellan provrören osv? :
Vad är det för skillnad mellan rör 1, 2 och 3?
Vad menar du med 00,2? (raden koncentration)
Sätt koncentration KMnO_4 i vänsterspalten istället
justera rutorna så att orden får plats
Du skriver inget siffervärde för koncentrationen av mangansulfat, men anger enheten mol/dm3.
Men du har inte svarat på min fråga , hur skulle du jämföra alla provrör?
Det kan jag inte, eftersom jag inte vet vad det är för skillnad mellan rör A, B och C (jga skrev visst 1, 2 och 3 förra gången). Varför ger de olika värde på reaktionshastigheterna fastän de verkar innehålla precis samma saker?
Skillnaden mellan A B C är sttnågra att A ett ml vatten och sedan lite svavelsyra och oxalsyra medan B innehöll mer och så på C också. Min fråga är om du kan resonera det vill säga ge likheter och olikheter mellan resultatet , vill få ett grep på det?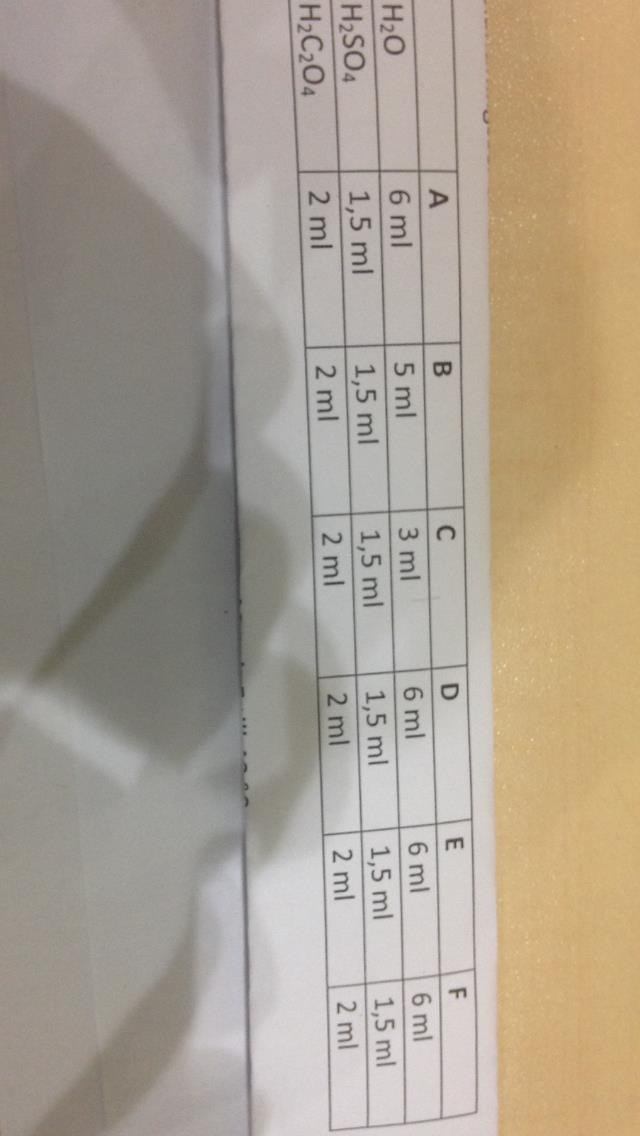
Har du olika volym kaliumpermanganatlösning i rör A, B och C? Det skulle förklara varför reaktionshastigheterna fördubblas, medan tiden är i stort sett konstant. Men du har skrivit att det är samma koncentration i alla tre rören... Det går inte ihop alls.
Volymen på provrör A :0.001, B: 0.002,C:0.004,D:0.001,E:0.001,F:0.001
Jag har skrivit koncentrationen för bara kaliumpermangnat inte oxalsyran som hade koncentrationen 0.2 och svavelsyran som hade koncentrationen 2.
Tidigare skrev du
Följande tillsatser skedde:
A: 1 ml KMnO4B: 2 ml KMnO4
C: 4 ml KMnO4
Det talar mot att det skulle vara samma koncentration av permanganatjoner i de tre rören. Det som är intressant är koncentrationen av permanganatjoner i reaktionskärlet (där du har blandat det med vatten, svavelsyra och oxalsyra), inte vilken koncentration det var i flaskan.
Ja exakt så var det!!
Går det att svara på min fråga nu eller behöver du något mer som jag har missat?
Du måste justera din tabell så att det är koncentrationerna i reaktionskärlet som står där, annars är det helt meningslöst. Så nej, jag kan inte svara på din fråga än.
Men vi i klassen skulle endast räkna ut reaktionshastigheten av kaliumpermangenat , vi ska inte räkna ut något annat.Det där du säger om reaktionskärlet skulle bara nämnas vid utförandet vilket jag gjort fast har inte skickat det till dig.
Du kan inte räkna ut reaktionshastigheten om du inte vet koncentrationen av reaktanten.
koncentrationen är 0.002 och volymen var det jag nämnde ovan , vi multiplicerade dessa och fick mol , därefter tog vi antalet mol vi fick på varje provrör delat på tiden det tog för provrören att visa vit färg , bam så fick vi reaktionshastigheten uttryckt som mol per sekund!
Räcker det här för att svara på mitt fråga eller behöver jag tillägga något mer?
Eftersom du har blandat i olika många ml kaliumpermanganat i vardera röret, men volymen i varje rör är samma, så blir koncentrationen av permanganatjoner olika i de tre rören. Så länge du inte har kommit fram till dessa koncentrationer är det inte meningsfullt att försöka hjälpa dig mer.
Jag förstår inte vad du frågar efter , kan du vara tydligare ?
Uppgiften var att beräkna reakionshastigheten av kaliumpermanganat. Kaliumpermangat lösningen har koncentration 0.002 och volymen hittar du ovan , jag multiplicerade dessa och fick mol. Därefter delade jag antalet mol på tiden och där fick jag fram kaliumpermanganet som reaktionshastighet.Jag skulle inte lägga mig i de andra koncentrationerna de var bara till för att reagera med kalium och permangatjoner tills det vita färgen skulle erhållas. Labbrapporten går ut på att räkna ut reaktionshastigheten av kaliumpermangantet men jag la koncentration av kaliumpermangnat på tabellen eftersom det var du som sa det till mig , känns onödigt . Jag tycker att jag borde endast ha tiden och reaktionshastighet eftersom det är endast detta resultat vi fick. Koncentrationerna var bara i labben de skulle inte räknas som resultat!!
Ta t ex rör A. Där har du blandat 1 ml KMnO_4 som jag tror har koncentrationen 0,02 mol/dm^3, 6 ml vatten, 1,5 ml svavelsyra och 2 ml oxalsyralösning med okänd koncentration (men det spelar ingen roll för min fråga). Vilken är koncentrationen för permanganatjoner?
Räkna sedan ut koncentrationen för permanganatjoner i samtliga rör.
Ovan är instruktionerna??
Varför ska jag räkna koncentrationen av permengnatjoner??
Snälla kan du inte svara på min fråga?
Bumpa inte. /moderator
Regel 1.8
Det är inte tillåtet att bumpa sin tråd inom ett dygn efter att du har postat tråden.
Bumpa betyder att en tråd flyttas upp i forumet genom att skriva inlägg i tråden som är tomma eller saknar mening i sammanhanget.
Regel 1.9
Det är inte tillåtet att bumpa sin tråd mer än en gång per dygn.
Bumpa betyder att en tråd flyttas upp i forumet genom att skriva inlägg i tråden som är tomma eller saknar mening i sammanhanget.
Hur gör du för att räkna ut reaktionshastigheten?
Jag förklarade tidigare , jag tog volymen gånger koncentartionen där jag fick mol , därefter tog jag antalet mol och delande det på antalet sekunder varje provrör hade tills vit färg erhålldes och sen fick jag reaktionshastigheten på varje provrör som uttrycktes som mol per sekund!
Så kan du besvara frågan , hur skulle du resonera kring resultatet ?
Då är det bättre att du sätter in en spalt med substansmängden av permanganatjoner, eftersom det är detta du har beräknat. Men den spalten behövs! Ta bort spalten med koncentrationer, för den är fel (de gäller inte koncentrationerna i reaktionsrören). Så du har rätt i att man inte behöver beräkna koncentrationen av permanganatjoner i rören.
Så nu har jag tillsatt substansmängd av KMno4 :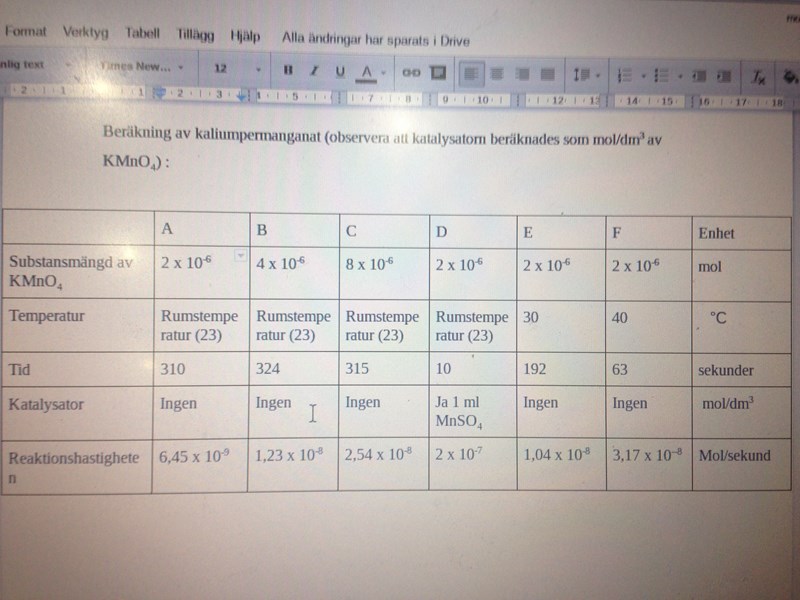 kan du besvara min fråga nu eller behöver jag tillägga något mer ? Min fråga var att resonera kring resultaten till exempel jämförelse ,likheter och olikheter ?
kan du besvara min fråga nu eller behöver jag tillägga något mer ? Min fråga var att resonera kring resultaten till exempel jämförelse ,likheter och olikheter ?
Vilken del av rapporten var det du vill ha ännu mer respons på? Lägg in den formulering du har för närvarande - jag vet inte hur mycket den skiljer sig från den ursprungliga.
På diskussion delen vill jag resonera ännu mer om resultatet , men jag vet inte hur jag ska jämföra resultaten och ge olikheter och likheter och det är det jag vill ha av dig , att just jämföra resultaten och ge likheter och olikheter?
Här är mitt diskussion del:
Diagrammet visar antalet sekunder för varje provrör det tog tills vit färg erhållits. (Observera att diagrammet går i ordning från A-F)
1.6 Diskussion
Det tycks som att hypotesen har falsifieras - det gick åt 10 sekunder för bägare D att visa vit färg medan bägare F dröjde det ytterligare 53 sekunder för att visa vit bakgrund. Det betyder att skillnaden var för stor vilket inte ligger nära felmarginalet för experimentet.Hypotesen utgick med att provrör F skulle visa vit färg innan de fem andra bägare A,B,C,D,E eftersom vatten baden innehöll 40 graders värme vilket innebar att energin av partiklarna skulle öka eftersom det var hög temperatur vilket skulle leda till högre hastighet. Eftersom 10 sekunder åtgick för att visa vit färg för provrör D så är skillnaden i sekunder mellan provrör D och F mer än fem ggr. Om hypotesen varit korrekt så borde högre temperaturen sätta igång reaktionen snabbare än alla andra provrör.
Vattenmolekylerna som innehöll svavelsyra och oxalsyra och var i ständig rörelse i varje provrör attackerade kaliumjonerna och permanganat jonerna , de kolliderade med partiklarna och förde över rörelseenergi till dem. Kaliumpermanganat som innehöll kaliumjoner och permanganatjoner som hälldes i vattnet blandat med svavelsyra och oxalsyra var inte längre låsta i sina positioner vilket gjorde att de blev fria och började vandra ut i vattnet.Där kolliderade kaliumpermanganat bestående av kaliumjoner och permanganatjoner med svavelsyra och oxalsyra som gjorde att de reagerade med varandra och förblev en kemisk reaktion eftersom aktiveringsenergin ökte mellan partiklarna.
När det gällde katalysatorn som tillsattes vid bägare D reagerande den själv men öppnade en ny och snabbare väg för kaliumpermanganat att reagera med svavelsyra och oxalsyran som även krävde låg aktiveringsenergi än vad temperaturen gjorde som krävde hög aktiveringsenergi.
Kan du svara på min fråga , som går ut på att jämföra resultaten av varje provrör det vill säga likheter och olikheter osv?
Det vore bättre att du skriver hypotesen som att "Vi tror att reaktionshastigheten kommer att vara högst i den varmeste lösningen" än att ni skriver "i bägare F" (desutom använde ni väl provrör, inte bägare?). Lösningarna blir inte vita, de blir färglösa (man kan också säga att de avfärgas).
Din beskrivning av vad som sker vid reaktionskärlet är helt horribel. Eftersom du läser Ke2 borde du veta att en vattenlösning av den starka syran svavelsyra inte innehåller några svavelsyramolekyler och att kaliumpermanganat är upplöst i kaliumjoner och permanganatjoner.
Katalysatorn har du beskrivit delvis riktigt men en del är fel och en del har du sagt två gånger.
Nej, jag tänker inte föreslå några bättre formuleringar. Det är du som skall skriva din labrapport, inte jag.
Men det var inte min fråga , min fråga är hur du skulle resonera kring resultatet , jag har väntat då tre timmar i onödan om du inte svarar på den här frågan???
Har jag försökt hjälpa dig i mer än ett dygn, och du bara klagar? Om jag inte har svarat på din fråga, så behöver du formulera din fråga bättre. Jag har lagt ner massor av tid på att försöka svara på det som jag trodde var dina frågor.
Jag gjorde det du sa för att svara på min fråga för i helvete , fan alltså hela tiden är borta nu , du kunde ha sagt från början att du inte kunde svara , inte nu när klockan är nio!!
Varning utdelad. /moderator
Regel 2.1
Iakttag vanlig etikett - använd ett vårdat språk, var trevlig och håll god ton.
Ser diskussion delen bättre nu och vad tycker du om slutsatsen? :
1.6 Diskussion
Det tycks som att hypotesen har falsifieras - det gick åt 10 sekunder för bägare D att visa avfärgning medan bägare F som innehöll det högsta värme dröjde ytterligare 53 sekunder för att visa avfärgning. Det betyder att skillnaden var för stor vilket inte ligger nära felmarginalet för experimentet.Hypotesen utgick med att att reaktionshastigheten skulle gå snabbast vid högsta temperatur och därmed ha den lägsta tiden att visa avfärgning. Provrör F presenterades som den högst värmad provrör under laborationen och skulle därför ta mindre tid att visa avfärgning innan de fem andra bägare A,B,C,D,E eftersom vatten baden innehöll 40 graders värme vilket innebar att energin av partiklarna skulle öka eftersom det var hög temperatur vilket skulle leda till högre hastighet. Eftersom 10 sekunder åtgick för att visa avfärgning för provrör D så är skillnaden i sekunder mellan provrör D och F mer än fem ggr. Om hypotesen varit korrekt så borde högre temperaturen sätta igång reaktionen snabbare än alla de andra provrören.
Från resultatet som har fåtts visas det att substansmängden för provrör A, B, D, F är detsamma detta beror på att det har fyllts lika mycket mängd som angavs på blandning schemat.Medan provrör A,B och C har ett annat antal mol , provrör B har dubbelts så mycket mol jämfört med bägare A det beror på att provrör B hade mindre volym av vatten vilket gjorde att koncentrationen blev högre och därmed ökade chansen att partiklarna träffade varandra var två gånger snabbare än vad provrör A gjorde.
När det gällde reaktionshastigheten så visades det att provrör F var ungefär dubbelt så stor som provrör E , detta berodde på att provrör F hade tio graders celsius mer än provrör E vilket gjorde att reaktionshastigheten gick snabbare för provrör F och därmed högre reaktionshastighet.
Resultatet bevisade att reaktionshastigheten för provrör C var dubbelt så mycket som provrör B , detta berodde på att vattenmängden av provrör C innehöll var 3 milliliter medan i provrör innehöll det 5 milliliter vatten , detta gjorde att ämnerna som hälldes i vattenlösningen hade vid provrör C hälften så stor volym som provrör B hade vilket gjorde att koncentrationen blev dubbelt så mycket för provrör C.
Reaktionskärlet det vill säga blandningen av vatten, svavelsyra och oxalsyra var i ständig rörelse i varje provrör och när kaliumjonerna och permanganat jonerna upplöstes i reaktionskärlet, kolliderade dem med partiklarna och förde över rörelseenergi till dem. Det betydde att reaktionskärlet inte längre fanns eftersom varje ämne var upplåst vilket gjorde att de blev fria och började vandra ut i vattnet tillsammans med kaliumjonerna och permanganat jonerna .De kolliderade med varandra och förblev en kemisk reaktion eftersom aktiveringsenergin ökte inom partiklarna.
När det gällde katalysatorn som tillsattes vid bägare D reagerande den själv men öppnade en ny och snabbare väg för kaliumpermanganat att reagera med svavelsyra och oxalsyran som även krävde låg aktiveringsenergi .
1.7 Slutsats
Det åtgick 10 sekunder för bägare D att visa avfärgning eftersom en katalysator har ett mycket lägre aktiveringsenergi än vad temperaturen hade och är därmed den snabbaste provrören som visade vit färg.
Inga kommentarer. Du har försuttit din chans. Jag tål inte att folk svär åt mig när jag försöker vara hjälpsam.
Ändras något om jag säger förslåt . Förlåt btw
Hon/han försöker hjälpa dig och du använder glåpord gentemot henne/honom? Wow, det är ju inte lärarens fel att du kommer med vaga formuleringar. istället för att hitta på egna formuleringar som inte är förståeliga så kan du fota uppgiften.
No reason to bash on someone who is trying to help you mate. Om du hade uteslutit svordomarna så hade det nog gått lite bättre






