Stereokemi vid bildning av cyklisk halvacetal från monosackarider
Skulle vilja ha lite hjälp att förstå varför OH-grupperna vid följande cyklisering av monosackariden pekar nedåt. Detta är molekylen i skelettstruktur:

Och såhär ser mekanismen + produkten ut:

Som kan ses, så pekar två av OH-grupperna (de som fanns från början) nedåt (eller in i pappret, men jag antar att det betyder nedåt när det är en ring, även om inte båda är axiellt nedåt), medan OH som bildades vid karbonylkolet kan peka antingen nedåt eller uppåt. Att karbonylkolets OH-grupp får den stereokemin förstår jag, men jag förstår inte helt varför båda OH-grupperna pekar nedåt? När en ring bildas, får kolen då den stereokemin som de har när bindningen roteras så att grupperna kommer uppåt (i skelettstrukturen alltså), d.v.s. på samma sätt som vid Fischerprojektioner. Det skulle ju isåfall förklara varför det kolet som pekade mot oss i skelettstrukturen nu pekar nedåt/inåt (för det är den konformationen den har om man skulle rotera sigma-bindningen).
Även om det ovan stämmer (vilket jag är osäker på), så förstår jag ändå inte riktigt, därför att när jag googlar på cyklisering av monosackarid, så står det att de grupper som pekar till vänster i Fischer kommer peka uppåt i ringen, och de grupper som pekar till höger i Fischer kommer peka nedåt. Fischerprojektionen för molekylen ser ju ut såhär:

Enligt detta skulle ju isåfall OH peka uppåt i ringen?
Som sagt, om det nu är så att man snurrar på sigma-bindningen på det kolet som har grupperna nedåt, så att man får grupperna uppåt och kolen nedåt innan ringen bildas (d.v.s. så som man gör vid Fischer), då förstår jag varför båda kolen får OH-grupper som blir "streckade". Och sen när attacken sker så fortsätter de OH-grupperna peka inåt i pappret, men jag får inte ihop det men "regeln" om att vänster i Fischer ska peka uppåt vid ringen?
Är det rätt tänkt, att man ritar samma konformation som i Fischer (så att alla grupperna är uppåt), vid en sådan "ring-attack"? Är det därför båda OH pekar nedåt/inåt (till skillnad från i skelettstrukturen där bara ena pekar in i pappret). Varför går inte "regeln" att använda här/har jag tolkat den fel?
Jag förstår att de kanske aldrig faktiskt lägger sig i Fischerprojektion-form (för det är väl eclipsed), och när den sedan hamnar i ringen så är det ju inte eclipsed, eftersom att varannan pekar uppåt axiellt, varannan uppåt ekvatoriellt, men är det så man ska tänka? Att kolen roterar så att grupperna hamnar uppåt (för att få rätt stereokemi)?
EDIT: Det kanske har att göra med vilket håll attacken sker på också, för det påverkar ju vilken sida det kolet utan OH-grupp ska ritas på. När den är ritad som skelettstrukturen så känns det ju logisk att om den attackerar på det hållet som den är ritad, så bör OH-grupperna hamna nedåt. Men när man googlar cyklisering av monosackarid, så ritar de också att attacken sker på höger sida i Fischerprojektionen, d.v.s. här på sidan med bara H, och ändå står det att vänster ska peka uppåt och höger nedåt... Och det kan jag ju inte göra, för om attacken (i Fischerprojektionen) sker på den högra sidan, borde det kolet utan OH fortfarande att hamna till vänster väl, och då blir det ju enantiomer istället om jag ritar OH-grupperna nedåt? Om det ska bli samma måste ju kolet utan OH hamna till höger istället.
Om du har tillgång till molekylmodeller skulle jag råda dig att direkt bygga ihop strukturen av D-erytros. För när du sedan ringsluter den, ser du hur samtliga grupper rör sig. (Har du inte redan en molekylbyggsats, är det väl värt att investera i om du tänker plugga organisk kemi, och för komplexare kolhydrater bör det tillhöra studiematerialet).
Ett sätt att visualisera varför de olika hydroxylgrupperna får just de positionerna, är att (precis som markerades i din bild) titta på bindningen mellan C2-C3.
Strukturen i din översta bild visare en (energi)idealiserad version av molekylen, men alla bindningar längs kolkedjan är enkla och tillåter rotation.
Och för att den terminala hydroxylgruppen på C4 skall kunna komma tillräckligt nära aldehydkolet C1, måste det ske rotationer, f.f.a. kring C2-C3 (men även C1-C2, samt C3-C4). Annars kommer inte hydroxylgruppen på C4 åt att anfalla C1.
Med samtliga atomer utritade blir det nog tydligare, när C2-C3 roterar 180°, och sedan även C1-C2 roterar 180° (eller tvärt om), motsvarande:
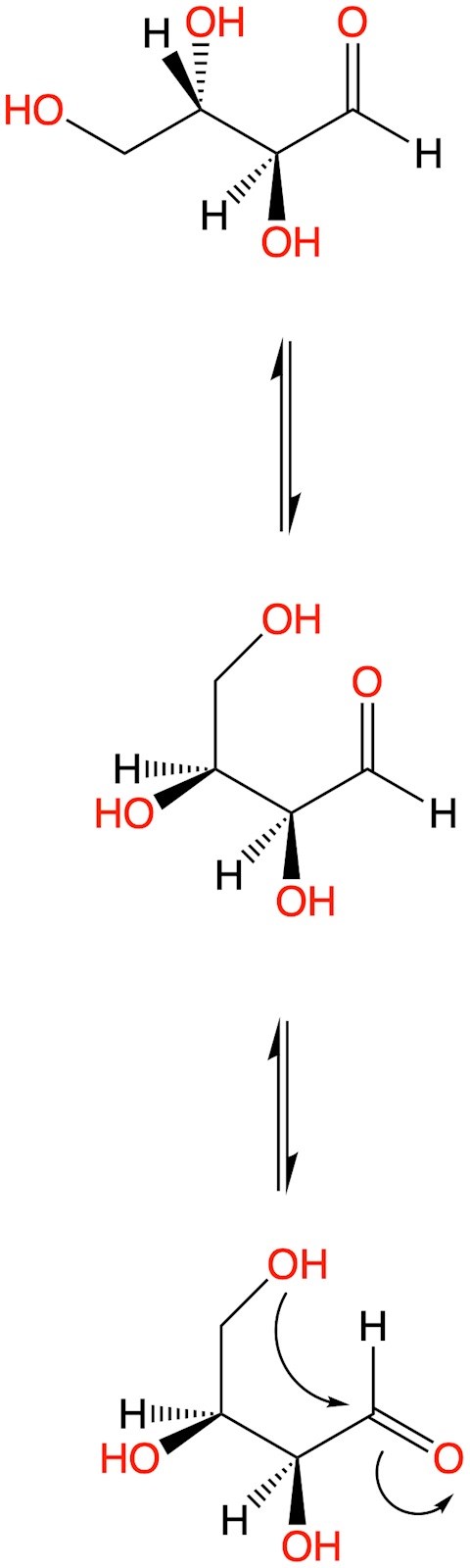
I denna illustration skulle de nedre två motsvara Fisherprojektionen, med alla kolatomer i samma linje och "du betraktar molekylen underifrån", för att få hydroxigrupperna på C2-C3 "på samma sida".
mag1 skrev:Om du har tillgång till molekylmodeller skulle jag råda dig att direkt bygga ihop strukturen av D-erytros. För när du sedan ringsluter den, ser du hur samtliga grupper rör sig. (Har du inte redan en molekylbyggsats, är det väl värt att investera i om du tänker plugga organisk kemi, och för komplexare kolhydrater bör det tillhöra studiematerialet).
Ett sätt att visualisera varför de olika hydroxylgrupperna får just de positionerna, är att (precis som markerades i din bild) titta på bindningen mellan C2-C3.
Strukturen i din översta bild visare en (energi)idealiserad version av molekylen, men alla bindningar längs kolkedjan är enkla och tillåter rotation.
Och för att den terminala hydroxylgruppen på C4 skall kunna komma tillräckligt nära aldehydkolet C1, måste det ske rotationer, f.f.a. kring C2-C3 (men även C1-C2, samt C3-C4). Annars kommer inte hydroxylgruppen på C4 åt att anfalla C1.
Med samtliga atomer utritade blir det nog tydligare, när C2-C3 roterar 180°, och sedan även C1-C2 roterar 180° (eller tvärt om), motsvarande:
I denna illustration skulle de nedre två motsvara Fisherprojektionen, med alla kolatomer i samma linje och "du betraktar molekylen underifrån", för att få hydroxigrupperna på C2-C3 "på samma sida".
Ah nu förstår jag! Tack för hjälpen!
För all del, kul att det hjälpte!

