Stoddard-cykel, adiabatiska och isobara reaktioner
En motor utnyttjar en Stoddard-cykel för sin funktion. 5,0 liter luft, en blandning
av N2 & O2, tas in vid trycket p1 =1,0 atm och komprimeras adiabatiskt till dubbla trycket.
Värme tillförs isobart så att volymen ökar med 60%, varefter luften expanderas adiabatiskt
tills ursprungstrycket nås. I sista steget kyls luften isobart till ursprungsvolymen. Rita
processen i ett pV-diagram, beräkna samtliga värmen och motorns verkningsgrad.
Jag kan inte förstå hur jag ska beräkna Q, värmen, för de isobara delarna (adiabatiska har Q=0), då jag behöver både T och n. Luft har 80% kväve och 20% syre.
Mavg = 32*0,2+28*0,8=28,8g/mol
För att få ut temperaturen i val fri punkt. Därefter använda . Men det går inte utan densiteten, .
, men till vilken temperatur av luftens densitet ska jag välja? (Det är fel formel för oavsett vad jag väljer blir det ett orimligt värde på mol)
Sedan undrar jag ifall jag får fram ett värde på Q, vilken formel är det för att få fram verkningsgraden? Hur vet jag ifall en Stoddard motor är carnotcykel eller värme maskin?
Rita processen i ett pV diagram!
Det har jag redan gjort, ska jag publicera den här genom ett foto eller? Dessutom vill jag tro att jag jag löst fram W på alla reaktioner. Förstår inte riktigt vad den ska hjälpa mig med dock.
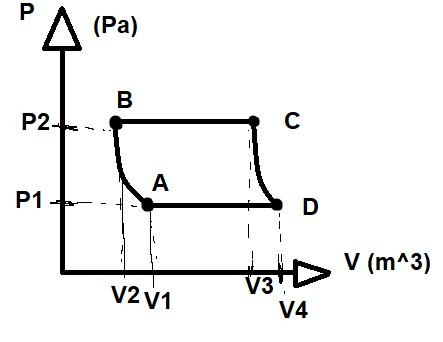
Gjorde en lika dan i paint lite snabbt.
idkman skrev:DeFörstår inte riktigt vad den ska hjälpa mig med dock.
Rita med alla värden på volym och tryck (och temperatur). Sedan kan du räkna ut värmeflöden och arbete.
men jag har väll inget sätt att få ut temperatur? det har varit en stor del till varför jag inte kan lösa problemet.
idkman skrev:men jag har väll inget sätt att få ut temperatur? det har varit en stor del till varför jag inte kan lösa problemet.
Man ska anta omgivningstemperatur för intaget.
så jag antar att det mest troliga antagandet är rumstemperatur? runt 20C eller 293K
Eller 300 kelvin. Det spelar inte så stor roll.
Nu är problemet att jag inte ser vilken väg jag ska ta för att beräkna ut TC så jag får ut QB-C.
Är det inte konstigt att använda när du uttryckligen vet att volymen ändras under en isobar process?
Tillägg: 17 maj 2022 16:30
Det är förövrigt vanligast att kalla detta för Brayton cykel eller Joulecykel om du vill hitta hjälp med Google.
Tillägg: 17 maj 2022 19:05
Till exempel är denna länk bra:
https://web.mit.edu/16.unified/www/SPRING/propulsion/notes/node27.html
Här går de igenom och kommer fram till en relation som kan hjälpa dig:
Eftersom och får vi med ideal gas-antagandet att:
För det första, jag förstår inte vad du menar med att jag gör något onödigt med att använda . Vet inte vad ska ha med att volymen ändras eller inte.
Tack för synonymerna var helt lost när inte min fysik bok nämner Staddord någon gång och internet var inte till mycket hjälp.
Vad jag har insett dock med hjälp av youtube är att jag kan lösa verkningsgraden med hjälp av bara . Men inget har hjälpt mig med att kunna lösa den .
Visst står det i din lärobok att cv är värmekapacitet vid konstant volym och att cp är värmekapacitet vid konstant tryck?
ja det gör det. har bara inte tänkt på att det kan orsaka en onödig användning av det
jaaa det är konstant tryck.. jag sak använda ...
visst ett räkne fel för Q, men kan fortfarande inte beräkna det utan att få tag på .
dessutom blir jag förvirrad av dessa youtube videos där de förklarar om vad det egentligen är och att det handlar om kompressorer och turbiner. Där de får fram , medans funktionen för W för en adiabatisk funktion är . För det första har de T på så vis så att det inte ger ett negativt tal? För annars säger de emot varandra. Därefter varför använder ena formeln c för konstant p medans den andra använder konstant V fast inget är konstant i en adiabatisk formel. Dessutom hur kan n bara påverka en av fyra formler och p, V detsamma. Eller är dessa W bara olika saker?
Ebola skrev:
Tillägg: 17 maj 2022 19:05
Till exempel är denna länk bra:
https://web.mit.edu/16.unified/www/SPRING/propulsion/notes/node27.html
Här går de igenom och kommer fram till en relation som kan hjälpa dig:
Eftersom och får vi med ideal gas-antagandet att:
Ser int riktigt vad detta ska ge mig för input för att få ut resterande temperaturer.
Jag förstår inte vad du inte förstår, tyvärr. Precis allting du behöver, steg för steg, är väldigt pedagogiskt framställt i länken.
För adiabatiska, reversibla processer har du:
Där adiabatiskt index för luft är . Detta innebär att du kan ta reda på alla okända tillståndsvariabler. Börja med att göra en tabell så som denna:
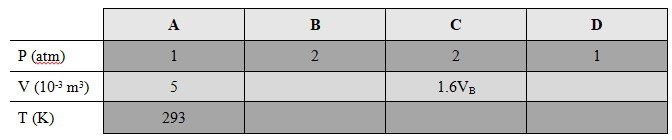
Där vi så klart antagit en temperatur i tillstånd A, som exempelvis STP eller 20 °C. Vi har att:
Detta ger oss som sedan ger oss . Båda dessa ger oss och från ideala gas-lagen genom att vi enkelt kan ta fram substansmängden . Slutligen använder vi:
Efter detta är hela tabellen fylld och att hitta värmen/arbete/verkningsgrad är en smal sak.
Allt detta förstår jag och jag har fått fram alla värden av dessa. Men jag kan inte beräkna T ifall gasen inte är idealisk men det vet jag inte om man bara anta för att göra det enklare.
för att kunna använda:
Du har redan antagit ideal gas och justeringen för luft i detta temperaturspann kommer inte förändra resultatet alls.
Det är en del av kursmålen för termodynamik på universitetsnivå att veta vad och varför man kan anta vissa saker (Edit: borde* vara, jag vet inte var du läser). En justering för växelverkan man gör är att ansätta adiabatiskt index till för luft genom att anta att den är diatomär. Detta är en extremt bra approximation (mindre än 3 % fel) i spannet 0 - 1000 °C.
Tack för all hjälp! tog bara ett fjärde försök. Bråkade med fler tal saker i uppgiften så glömde saker på vägen. Nu klarade jag det väldigt smidigt och enkelt.




