Sura aminosyrors isoelektiska punkt
De flesta aminosyror är väl i sin amfojonsform vid sin isoelektriska punkt. De aminosyror som är sura eller basiska har ju inte en jämn laddning. Kallas detta ändå deras amfojonform? Och är det i så fall den som de har vid sin isoelektiska punkt? Eller vilken form har dem vid denna, för de är ju alltid laddade?
De flesta aminosyror är väl i sin amfojonsform vid sin isoelektriska punkt.
Detta gäller per definition, så det gäller alla aminosyror. Isoelektrisk punkt är en punkt på pH skalan där molekylen totalt sett är neutral, dvs det är en amfojon (eller zwitterjon).
Angående basiska eller sura aminosyror så har de också en isoelektrisk punkt. Basiska amino har typiskt högre PI medan sura aminosyror har lägre. Jämför tex arginin eller asparginsyra.
Däremot brukar man tala om proteiners isoelektriska punkt, inte aminosyrors.
Qetsiyah skrev:De flesta aminosyror är väl i sin amfojonsform vid sin isoelektriska punkt.
Detta gäller per definition, så det gäller alla aminosyror. Isoelektrisk punkt är en punkt på pH skalan där molekylen totalt sett är neutral, dvs det är en amfojon (eller zwitterjon).
Angående basiska eller sura aminosyror så har de också en isoelektrisk punkt. Basiska amino har typiskt högre PI medan sura aminosyror har lägre. Jämför tex arginin eller asparginsyra.
Däremot brukar man tala om proteiners isoelektriska punkt, inte aminosyrors.
Men jag förstår inte riktigt, de sura och basiska aminosyrorna (proteinerna) är väl inte neutrala vid sin amfojonsform för de har ju två av det ena (positiv eller negativ) och en av det andra.
Det blir nog lättast att diskutera aminosyror för sig, och proteiner för sig (då proteinerna är mer komplexa).
Aminosyrorna har vid ett individuellt pH ingen övergripande laddning. Då är summan av partikelns alla funktionella gruppers laddningar noll - vilket är definitionen av en zwitterjon (amfojon).
Den isoelektriska punkten definieras på samma vis, att nettoladdningen hos en molekyl är noll. IP används för (mycket) större molekyler som proteiner, till skillnad från zwitterjon som beskriver just en jon (d.v.s. för betydligt mindre partiklar).
mag1 skrev:Det blir nog lättast att diskutera aminosyror för sig, och proteiner för sig (då proteinerna är mer komplexa).
Aminosyrorna har vid ett individuellt pH ingen övergripande laddning. Då är summan av partikelns alla funktionella gruppers laddningar noll - vilket är definitionen av en zwitterjon (amfojon).
Den isoelektriska punkten definieras på samma vis, att nettoladdningen hos en molekyl är noll. IP används för (mycket) större molekyler som proteiner, till skillnad från zwitterjon som beskriver just en jon (d.v.s. för betydligt mindre partiklar).
Men hur blir det då med aminosyror med basisk/sur sidokedja om man ska rita de vid dess Ip? De har ju två laddningar av det ena så de blir ju ej neutrala. Och den formen som de då får vid dess Ip, är det amfojonen (zwitterjonen)?
mag1 skrev:Det blir nog lättast att diskutera aminosyror för sig, och proteiner för sig (då proteinerna är mer komplexa).
Aminosyrorna har vid ett individuellt pH ingen övergripande laddning. Då är summan av partikelns alla funktionella gruppers laddningar noll - vilket är definitionen av en zwitterjon (amfojon).
Den isoelektriska punkten definieras på samma vis, att nettoladdningen hos en molekyl är noll. IP används för (mycket) större molekyler som proteiner, till skillnad från zwitterjon som beskriver just en jon (d.v.s. för betydligt mindre partiklar).
För i min lärobok finns den här bilden. Vad heter denna formen av aminosyran? För jag trodde först att detta var amfojonen med att glutaminsyra inte hade sin amfojonsform vid Ip, men så verkar det ju ej vara? 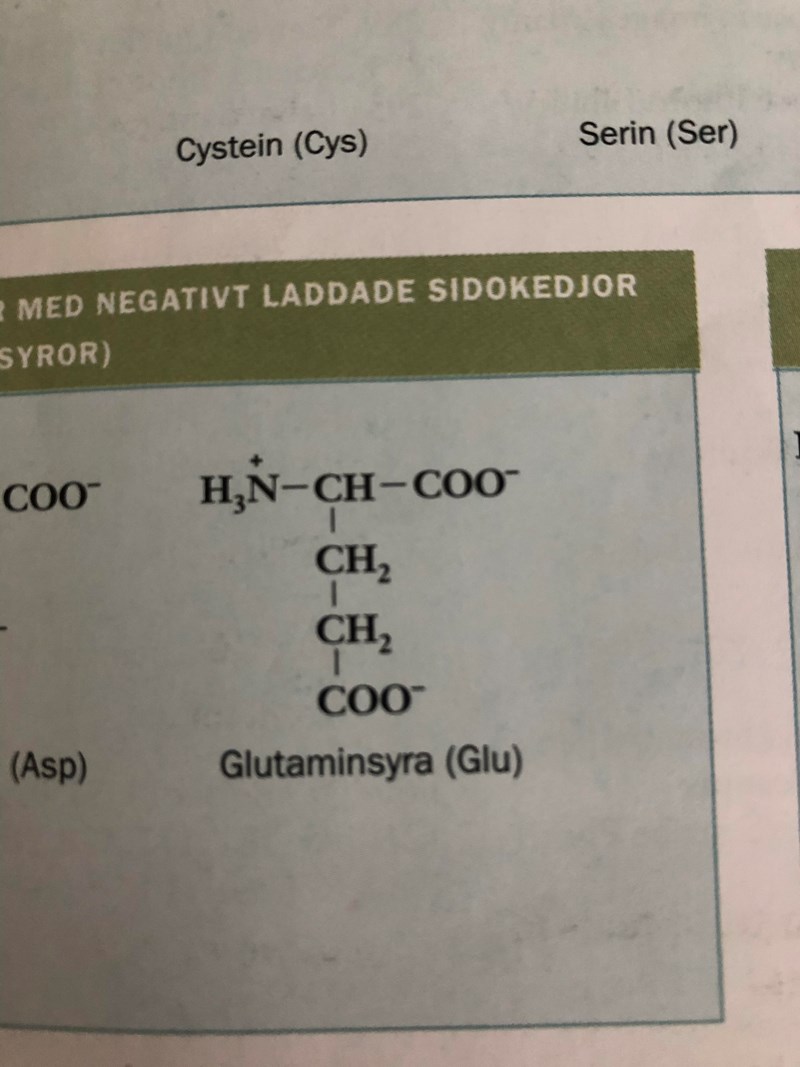
Alla aminosyror har en aminogrupp och en karboxylsyragrupp, som vid neturalt pH har laddingarna +1 och -1, vilket ger nettoladdningen noll.
Så vid detta pH avgörs aminosyrans laddning av den basiska/sura sidokedjans laddning. När denna tredje funktionella gruppen saknar laddning, och aminogruppens och karboxylsyragruppens laddningar tar ut varandra är hela molekylens nettladdning noll - och då har de basiska/sura aminosyrorna zwitterjonformen (amfojonformen).
Vid neutralt pH är t.ex. asparginsyrans sidokedja protolyserad, och har laddningen -1. Aminogruppens och karboxylsyragruppens laddningar tar ut varandra (-1, +1), så nettoladdningen blir -1, den är med andra ord inte i zwitterjonformen.
Men vid pH nära pKa värdet för asparginsyrans sidokedja kommer sidokedjans karboxylsyragrupp att ta upp en proton och tappa den negativa laddningen, och då får hela aminosyran zwitterjonformen.
Och sjunker pH lite till ner till pKa värdet för karboxylsyragruppen kommer även den att ta upp en proton, och nettoladdningen blir +1 (från den enda laddade gruppen som finns kvar, aminogruppen).
mag1 skrev:Alla aminosyror har en aminogrupp och en karboxylsyragrupp, som vid neturalt pH har laddingarna +1 och -1, vilket ger nettoladdningen noll.
Så vid detta pH avgörs aminosyrans laddning av den basiska/sura sidokedjans laddning. När denna tredje funktionella gruppen saknar laddning, och aminogruppens och karboxylsyragruppens laddningar tar ut varandra är hela molekylens nettladdning noll - och då har de basiska/sura aminosyrorna zwitterjonformen (amfojonformen).
Vid neutralt pH är t.ex. asparginsyrans sidokedja protolyserad, och har laddningen -1. Aminogruppens och karboxylsyragruppens laddningar tar ut varandra (-1, +1), så nettoladdningen blir -1, den är med andra ord inte i zwitterjonformen.
Men vid pH nära pKa värdet för asparginsyrans sidokedja kommer sidokedjans karboxylsyragrupp att ta upp en proton och tappa den negativa laddningen, och då får hela aminosyran zwitterjonformen.
Och sjunker pH lite till ner till pKa värdet för karboxylsyragruppen kommer även den att ta upp en proton, och nettoladdningen blir +1 (från den enda laddade gruppen som finns kvar, aminogruppen).
Men om man då t.ex. vet att asparginsyran har IP=3 (läste att du skrev att det gällde för större molekyler men de frågar efter detta i läroboken), då betyder det alltså att den INTE har sin zwitterjonsform vid detta pH, utan istället är sidokedjan protolyserad. Om pH sjunker ännu mer så protolyseras även karboxylsyran? Om pH istället höjs över IP, avges vätet från amingruppen. Har jag tolkat det rätt, vet inte om det är det som du menar med pKa?
Betyder detta också att de aminosyror som inte har sura/basiska sidokedjor, de har sin amfojonsform vid IP?
sund20 skrev:mag1 skrev:Alla aminosyror har en aminogrupp och en karboxylsyragrupp, som vid neturalt pH har laddingarna +1 och -1, vilket ger nettoladdningen noll.
Så vid detta pH avgörs aminosyrans laddning av den basiska/sura sidokedjans laddning. När denna tredje funktionella gruppen saknar laddning, och aminogruppens och karboxylsyragruppens laddningar tar ut varandra är hela molekylens nettladdning noll - och då har de basiska/sura aminosyrorna zwitterjonformen (amfojonformen).
Vid neutralt pH är t.ex. asparginsyrans sidokedja protolyserad, och har laddningen -1. Aminogruppens och karboxylsyragruppens laddningar tar ut varandra (-1, +1), så nettoladdningen blir -1, den är med andra ord inte i zwitterjonformen.
Men vid pH nära pKa värdet för asparginsyrans sidokedja kommer sidokedjans karboxylsyragrupp att ta upp en proton och tappa den negativa laddningen, och då får hela aminosyran zwitterjonformen.
Och sjunker pH lite till ner till pKa värdet för karboxylsyragruppen kommer även den att ta upp en proton, och nettoladdningen blir +1 (från den enda laddade gruppen som finns kvar, aminogruppen).
Men om man då t.ex. vet att asparginsyran har IP=3 (läste att du skrev att det gällde för större molekyler men de frågar efter detta i läroboken), då betyder det alltså att den INTE har sin zwitterjonsform vid detta pH, utan istället är sidokedjan protolyserad.
Nej, vid IP saknar aminosyran nettoladdning: sidokedjans karboxylsyra har tagit upp en proton (oladdad), aminogruppen har också tagit upp en proton (+1), samt karboxylsyran (som är gemensam för alla aminosyror -1) = nettoladdning 0.
Om pH sjunker ännu mer så protolyseras även karboxylsyran?
Nej tvärt om, om pH sjunker ökar koncentrationen av protoner och karboxylsyror kommer i högre grad att ta upp en proton.
Om pH istället höjs över IP, avges vätet från amingruppen. Har jag tolkat det rätt, vet inte om det är det som du menar med pKa?
Ökar pH över IP kommer sidokedjan protolyseras (d.v.s. övergå från -COOH till COO- och en fri H+).
Betyder detta också att de aminosyror som inte har sura/basiska sidokedjor, de har sin amfojonsform vid IP?
Ja det gäller för alla aminosyror, det är en del av definitionen - att nettoladdningen är noll vid IP.
mag1 skrev:sund20 skrev:mag1 skrev:Alla aminosyror har en aminogrupp och en karboxylsyragrupp, som vid neturalt pH har laddingarna +1 och -1, vilket ger nettoladdningen noll.
Så vid detta pH avgörs aminosyrans laddning av den basiska/sura sidokedjans laddning. När denna tredje funktionella gruppen saknar laddning, och aminogruppens och karboxylsyragruppens laddningar tar ut varandra är hela molekylens nettladdning noll - och då har de basiska/sura aminosyrorna zwitterjonformen (amfojonformen).
Vid neutralt pH är t.ex. asparginsyrans sidokedja protolyserad, och har laddningen -1. Aminogruppens och karboxylsyragruppens laddningar tar ut varandra (-1, +1), så nettoladdningen blir -1, den är med andra ord inte i zwitterjonformen.
Men vid pH nära pKa värdet för asparginsyrans sidokedja kommer sidokedjans karboxylsyragrupp att ta upp en proton och tappa den negativa laddningen, och då får hela aminosyran zwitterjonformen.
Och sjunker pH lite till ner till pKa värdet för karboxylsyragruppen kommer även den att ta upp en proton, och nettoladdningen blir +1 (från den enda laddade gruppen som finns kvar, aminogruppen).
Men om man då t.ex. vet att asparginsyran har IP=3 (läste att du skrev att det gällde för större molekyler men de frågar efter detta i läroboken), då betyder det alltså att den INTE har sin zwitterjonsform vid detta pH, utan istället är sidokedjan protolyserad.
Nej, vid IP saknar aminosyran nettoladdning: sidokedjans karboxylsyra har tagit upp en proton (oladdad), aminogruppen har också tagit upp en proton (+1), samt karboxylsyran (som är gemensam för alla aminosyror -1) = nettoladdning 0.
Om pH sjunker ännu mer så protolyseras även karboxylsyran?
Nej tvärt om, om pH sjunker ökar koncentrationen av protoner och karboxylsyror kommer i högre grad att ta upp en proton.
Om pH istället höjs över IP, avges vätet från amingruppen. Har jag tolkat det rätt, vet inte om det är det som du menar med pKa?
Ökar pH över IP kommer sidokedjan protolyseras (d.v.s. övergå från -COOH till COO- och en fri H+).
Betyder detta också att de aminosyror som inte har sura/basiska sidokedjor, de har sin amfojonsform vid IP?
Ja det gäller för alla aminosyror, det är en del av definitionen - att nettoladdningen är noll vid IP.
När avges vätet från amingruppen då? Alltså får den aldrig en laddning som är 0? Om karboxylsyran tar upp ett väte vid låga pH (för att den då fungerar som en bas), borde inte amingruppen avge vätet vid höga pH då? Eller är det detta som är speciellt för sura/basiska sidokedjor, att dessa aminosyror istället får sidokedjan ex. protolyserad? För en "vanlig" aminosyra avger väl ett väte från amingruppen vid höga pH (fungerar som en syra) och den får då nettoladdningen -1.
EDIT: Eller ja, en sur aminosyra får ju också nettoladdning -1 vid höga pH om sidokedjan protolyseras. Men betyder det att väte från amingruppen (som då är NH3+ eftersom den har tagit upp en proton) aldrig avges hos en sur aminosyra?
Isåfall, blir det samma med en basisk aminosyra? Dess karboxylsyra gör ingenting utan är i form av COO- hela tiden. Vid höga pH (högre än IP) så avger amingruppen protoner, och vid låga pH så tar sidokedjans amingrupp upp protoner?
sund20 skrev:
När avges vätet från amingruppen då? Alltså får den aldrig en laddning som är 0? Om karboxylsyran tar upp ett väte vid låga pH (för att den då fungerar som en bas), borde inte amingruppen avge vätet vid höga pH då? Eller är det detta som är speciellt för sura/basiska sidokedjor, att dessa aminosyror istället får sidokedjan ex. protolyserad? För en "vanlig" aminosyra avger väl ett väte från amingruppen vid höga pH (fungerar som en syra) och den får då nettoladdningen -1.
Ja precis vid ett högt pH lämnar de ifrån sig den extra protonen (t.ex. arginins sidokedja har ett pKa på 12,5).
EDIT: Eller ja, en sur aminosyra får ju också nettoladdning -1 vid höga pH om sidokedjan protolyseras. Men betyder det att väte från amingruppen (som då är NH3+ eftersom den har tagit upp en proton) aldrig avges hos en sur aminosyra?
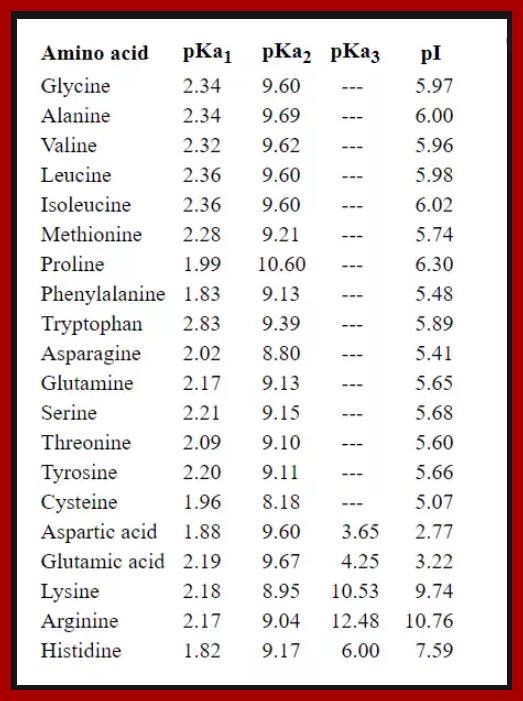
Jodå, den avges när pH blir tillräckligt högt, titta i tabellen Qetsiyah lade in, pKa2 är för aminogruppen - så när pH ett par enheter över t.ex. arginins pKa2 blir aninogruppen oladdad. Du ser det på PI värdet 10.8 (som ligger ungefär 2 pH enheter över pKa2) - och då saknar arginin nettoladdning (sidokedjan sankar laddning, karboxylsyran ger -1 och sidokedjan +1).
Isåfall, blir det samma med en basisk aminosyra? Dess karboxylsyra gör ingenting utan är i form av COO- hela tiden. Vid höga pH (högre än IP) så avger amingruppen protoner, och vid låga pH så tar sidokedjans amingrupp upp protoner
Nja, blir pH riktigt lågt kommer karboxylsyran ta upp en proton och bli oladdad, och aminosyran får laddningen +2 (en positiv laddning per aminogrupp).


