Svår A Uppgift på Balansering av Redoxformel
Hej!
Har en svår reaktion som jag har haft problem med att lösa, den lyder:
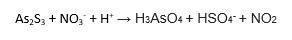
I uppgiften så står det att As har oxidationstalet: +III i VL.
Jag har kommit fram till: 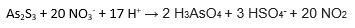
Jag har fått fram rätt antal Syre i båda leden och lika laddningar men jag har fel antal väte.
Har inte kollat så noga, men är det inte bara att ändra antalet H+ till något lämpligt?
Har försökt, men får fel laddningar mellan leden. Man kanske kan dela upp dom till joner och försöka lösa så. Jag fattar inte, men man ska kunna lösa uppgiften.
Aha, det såg jag inte!
Om vi tar X, Y och Z av de tre sakerna på vänstra sidan så måste man få 2X, 3X och Y av sakerna på högra sidan för att balansera As, S och N.
Samtidigt ska Y - Z = 3X för att få laddningen rätt.
Och även Z = 2X*3 + 3X = 9X för att få vätet rätt.
Möjligen har jag missat något mer samband.
EDIT: många tryckfel från mig idag, men nu är det nog nästan rätt...
Hur kommer detta att hjälpa oss? Vad jag kan se i denna reaktionen, så är det 2 st oxidationer och 1 reduktion, men hur räknar ut koeffecienterna?
Jag glömde balansera O!
3Y = 2X*4 + 3X*4 + Y*2
Det finns då 3 obekanta och 3 ekvationer (de tre jag kallar laddning, väte och syre).
Jag får att det inte går ihop!
Antingen har jag otur när jag tänker eller så saknas det vatten eller annat i formeln.
Börja om från början, du har helt fel proportioner mellan arsenik och nitratjoner.
Vad har As för oxidationstal på högersidan? Vad har N för oxidationstal på de båda sidorna? Den sammanlagda ökningen av oxidationstal måste vara lika stor som den sammanlagda minskningen av oxidationstal, annars är det hopplöst att föröka komma rätt.
EDIT: Jag hade fel, se nedan.
VL:
N = oxtal +V (5)
As = oxtal +III (3)
S = oxtal -II (2)
HL:
N = oxtal +IV (4)
As = oxtal +V (5)
S = oxtal +VI (6)
Oj, att svavlet ändrade ox.tal också hade jag missat helt! Hur många steg oxideras varje ? Hur många nitratjoner behöver reduceras för att det skall bli lika många steg?
Då får jag erkänna att jag hade fel där uppe. Det blir faktiskt 20 nitratjoner för varje arseniksulfid.
Om jag ar räknat rätt den är gången, finns et 60 syre på vänstersidan men bara 51 på högersidan. Då måste det ha bildats 9 vattenmolekyler också. Kan du få vätet och laddningen tt tämma då?
 Tack för hjälpen !
Tack för hjälpen !
Och jag lyckades få 3*8 till 18 på kvällen - då är man för trött.
28 nitratjoner som reagerarmed en arseniksulfid - det hör nog till de största koefficienter jag har sett i en kemisk reaktionsformel.



