syra baser kolsyra
Hej!
Jag har gjort den här uppgiten, men fick fel på d delen, förstår inte riktigt hur facit menar, betyder det även att Hco3- tillsammans med H2co3 också bildar 0,100 M?
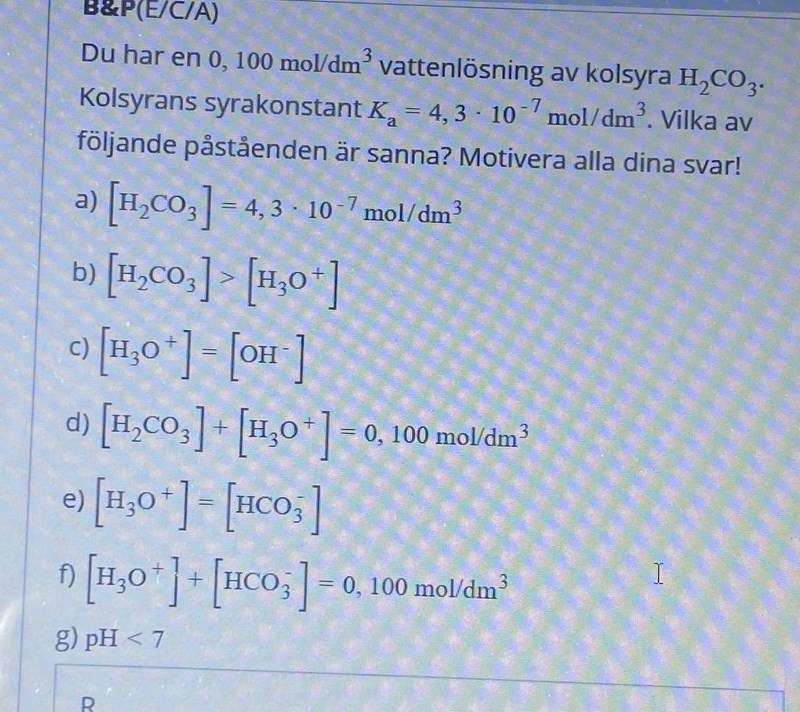
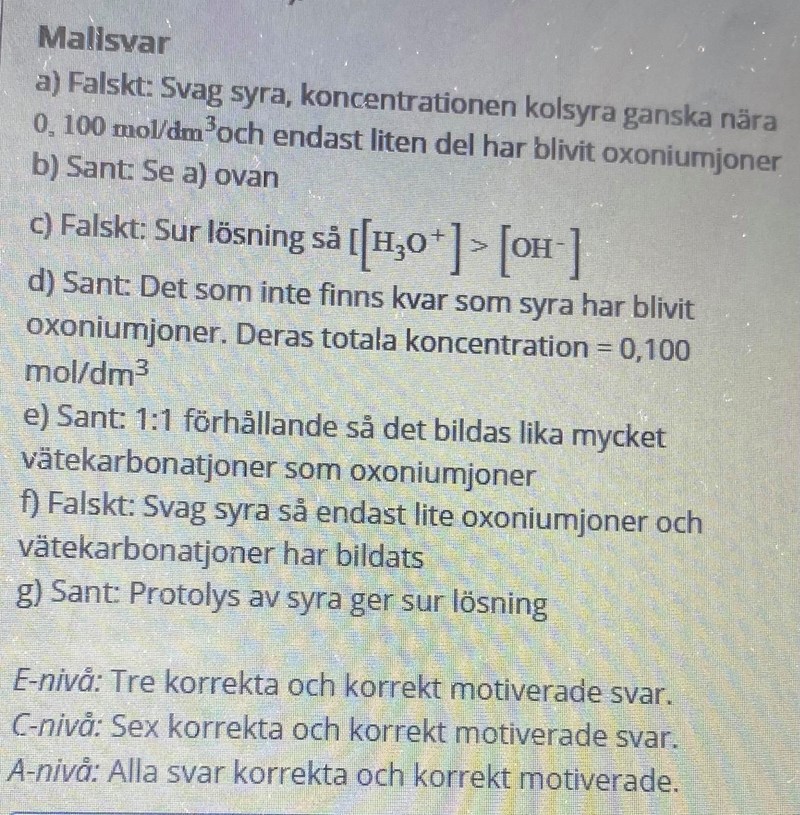
Om man enbart ser till jämvikten mellan divätekarbonat och vätekarbonat så kan man nog anse den vara korrekt, egentligen så är summan av alla ingående joner + syran = 0.100 M.
När din syra dissocierar helt så innebär det att [oxoniumjoner]=0.100 M. Du vet att det är en svag syra, därför kommer en viss mängd dissociera, det medför självklart att du kommer att ha en viss koncentration divätekarbonat kvar. Därför gäller självklart att [divätekarbonat]+[oxonoiumjoner]=0.100 M då det är din startkoncentration.
förstår inte riktigt hur du menar, kan du vara snäll och förklara lite mer
En stark syra dissocierar till 100 %, vilket innebär att alla 0.100 M syra övergår till 0.100 M oxoniumjoner. Det innebär därför att du har 0 M syra kvar.
En svag syra dissocierar INTE till 100 %, vilket innebär att det som finns i lösningen är syra som inte har dissocierat plus oxoniumjoner (plus den korresponderande basen).
Då förstår jag, så syran ovan är en stark syra och därför är koncentrationerna detsamma?


