Syror och Baser,Kemi 1,Neutralisation med Natriumhydroxid och Svavelsyra
Hej!
Jag har problem med en fråga gällande syror och baser. Frågan lyder så här->
150 ml natriumhydroxid med koncentrationen 0,5 mol/dm3 neutraliseras med svavelsyra med koncentrationen 0,1 mol/dm3. Hur stor volym av syran går åt?
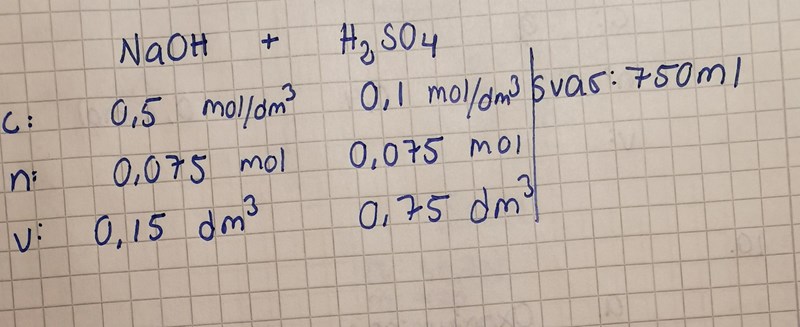
Detta är det jag kommit fram till hittills men det är fel. Jag får svaret 750 ml när det i facit står att det ska vara 375ml.
Tacksam för svar!
Hej, välkommen till pluggakuten
Det är faktiskt så att EN svavelsyra kan neutralisera TVÅ stycken NaOH, därför är rätt svar exakt hälften av det du fick.
Förstår du?
Hej igen!
Okej, men hur kan den göra det?
Är det för att svavelsyran är en tvåprotoning syra, eller är det något annat det beror på?
Jo, exakt därför, den är två protonig.
Okej,tack så mycket för hjälpen!
Och en till kommentar, en grej jag va förvirrad över själv, baser och syror nautraliserar varandra oavsett hur starka de är. Tex i detta fall är den andra protonen i H2SO4 är ganska svag jämfört med den första, dvs den avges inte så enkelt, men det spelar ingen roll, den kommer ändå neutralisera en NaOH.


