Teoretiskt pH-värde vid ekvivalenspunkten för en titrering av TRIS med saltsyra
Utfrån 15 ml 0,10 M HCl (aq) hälls motsvarande mängd tris. Molförhållandena är 1:1 och därför krävs alltså 0,0015 mol tris för fullständig neutralsiation. Eftersom tris har en korresponderande syraform tänker jag att [TRIS+H] ⇔[TRIS]+[H+]. [H+] = 0,0015/0,015 = 0,1 mol/l ⇒pH = 1. Är detta verkligen rimligt?
Nej, det är inte rimligt, det har du rätt i. Det du har räknat ut är pH i saltsyran.
Om du blandar ekvivalenta mängder TRIS och atark syra, så blir det samma situation som om du löst upp samma substansmängd av ett TRIS-salt. Det blir alltså sammasituation som om du har en lösning av salmiak, NH4Cl. Räkna på en liter, så att det blir samma siffror för koncentrationerna som för substanmängderna. Om du löser upp a mol salmiak i en liter vatten, så kommer x mol av ammoniumjonerna att reagera med vattnet så att det bildas x mol oxoniumjoner och x mol ammoniak medan det finns a-x mol ammoniumjoner kvar. Ekvationen som man behöver lösa ut x ur är , och när man vet x är det ganska lätt att beräkna pH.
Kommer du vidare?
Smaragdalena skrev:Nej, det är inte rimligt, det har du rätt i. Det du har räknat ut är pH i saltsyran.
Om du blandar ekvivalenta mängder TRIS och atark syra, så blir det samma situation som om du löst upp samma substansmängd av ett TRIS-salt. Det blir alltså sammasituation som om du har en lösning av salmiak, NH4Cl. Räkna på en liter, så att det blir samma siffror för koncentrationerna som för substanmängderna. Om du löser upp a mol salmiak i en liter vatten, så kommer x mol av ammoniumjonerna att reagera med vattnet så att det bildas x mol oxoniumjoner och x mol ammoniak medan det finns a-x mol ammoniumjoner kvar. Ekvationen som man behöver lösa ut x ur är , och när man vet x är det ganska lätt att beräkna pH.
Kommer du vidare?
Smaragdalena skrev:Nej, det är inte rimligt, det har du rätt i. Det du har räknat ut är pH i saltsyran.
Om du blandar ekvivalenta mängder TRIS och atark syra, så blir det samma situation som om du löst upp samma substansmängd av ett TRIS-salt. Det blir alltså sammasituation som om du har en lösning av salmiak, NH4Cl. Räkna på en liter, så att det blir samma siffror för koncentrationerna som för substanmängderna. Om du löser upp a mol salmiak i en liter vatten, så kommer x mol av ammoniumjonerna att reagera med vattnet så att det bildas x mol oxoniumjoner och x mol ammoniak medan det finns a-x mol ammoniumjoner kvar. Ekvationen som man behöver lösa ut x ur är , och när man vet x är det ganska lätt att beräkna pH.
Kommer du vidare?
En deprimerande bild men såhär räknar jag:
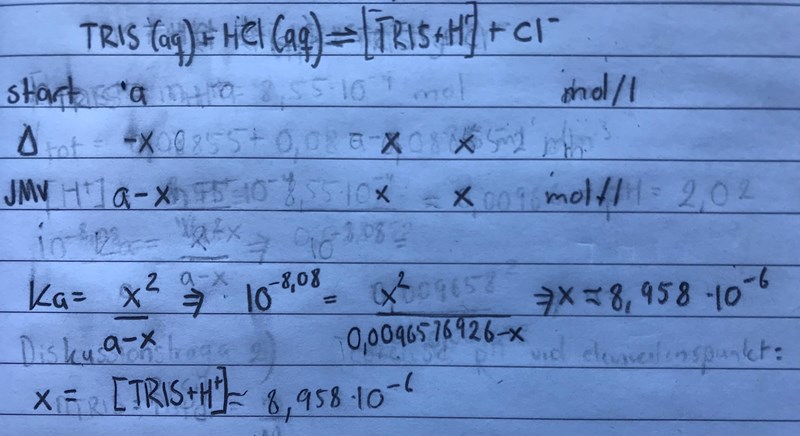
Dock vet jag inte hur koncentrationen [TRIS+H+] kan hjälpa till. Om jag subtraherar den med a får jag förvisso hur mycket TRIS som inte har reagerat. Kan jag tolka det som att det finns lika många fria vätejoner i lösningen för att räkna pH? Isåfall är jag på ruta 1, där jag räknar ut pH i saltsyran.
(Det här svaret knyter inte riktgit till det första inlägget, men det är ett liknande problem. Man ska alltså beräkna pH vid ekvivalenspunkten då 10,4 ml 0,1 M saltsyra blandas med motsvarande mängd 0,013 M TRIS + 80 ml vatten varför a blir lite annorlunda.)
Tänk dig att du har en hel liter HCl med koncentrationen 0,10 M och tillsätter lika stor substansmängd tris. Då är a = 0,10 mol/dm3 och ekvationen blir x2/(0,1-x) = 8,08. Varför har du ett annat värde på a än det som står i uppgiften, nämligen att a = 0,10 M? Bortsett från detta ser du ut att ha fått fram ett rimligt värde på x, Vilket pH-värde motsvarar detta?
Att räkna ut pH-värdet när du har tillsatt NaOH till din buffertlösning ett helt annat problem än det du har beskrivit i den här trådstarten. Då kommer hydroxidjonerna att till stor del reagera med "syra-tris" så att pH-värdet bara kommer att ändras lite, lite trots att samma bastillsats gav en pH-ändring på ungefär 6 steg utan buffert.
Smaragdalena skrev:Tänk dig att du har en hel liter HCl med koncentrationen 0,10 M och tillsätter lika stor substansmängd tris. Då är a = 0,10 mol/dm3 och ekvationen blir x2/(0,1-x) = 8,08. Varför har du ett annat värde på a än det som står i uppgiften, nämligen att a = 0,10 M? Bortsett från detta ser du ut att ha fått fram ett rimligt värde på x, Vilket pH-värde motsvarar detta?
Att räkna ut pH-värdet när du har tillsatt NaOH till din buffertlösning ett helt annat problem än det du har beskrivit i den här trådstarten. Då kommer hydroxidjonerna att till stor del reagera med "syra-tris" så att pH-värdet bara kommer att ändras lite, lite trots att samma bastillsats gav en pH-ändring på ungefär 6 steg utan buffert.
Just det! Talet a ska vara en koncentration. Det jag har räknat ut är susbtansmängden TRIS.
Tillägg: När jag nu räknar om x med a som koncentration får jag x till ungefär 9,120*10^-5. pH-värdet blir 4,04. Jag hade emellertid vetat resonera att ''a-x'' motsvarar koncentrationen tris som inte har reagerat med fria vätejoner. Eftersom den är ekvivalent med koncentrationen vätejoner borde ''a-x'' avgöra pH-värdet. Om jag nu bara räknar -log[x] som jag har gjort får jag koncentrationen [TRIS+H+]. Detta säger inget om pH. Hoppas du förstår mig!
Dock skrev jag fel på den andra tråden! I försök 2 är det en titrering av TRIS med bara saltsyra och vatten och inte NaOH. Här vägs det upp 0,1036 g TRIS som löses i 80 ml vatten. Sedan görs en potentiometrisk titrering och man ska räkna ut ett teoretiskt värde för pH vid ekvivalenspunkten. Är detta rimligt tycker du? Det kan tillägas att jag även ställde upp massverkans lag och fick samma svar när jag räknade ut a-x som jag fick när jag logaritmerade koncentrationen [TRIS+H+]-joner. Kan det vara en antydan på att resonemanget i föregående inklägg var rätt?
Min lösning:
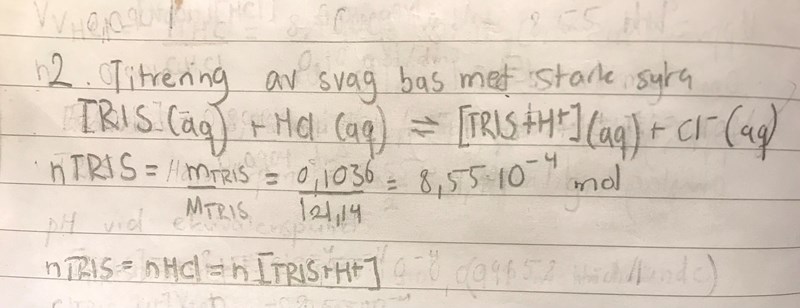
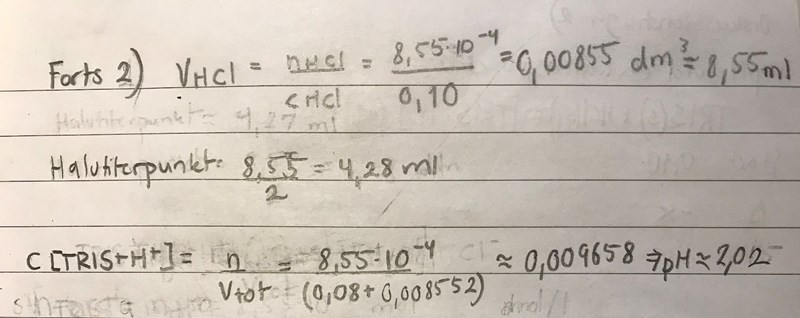
Tillägg: jag förmodar att detta är fel då det experimentella värdet var 5,16:(
Nu när jag räknar på denna ekvation igen (för försök 2 (saltsyra + tris + 80 ml vatten men inte NaOH) får jag äntligen ett rimligt värde (pH= 5.05). Jag har nu förstått att man räknar att med att all TRIS att tillbakabildas från sin korresponderande syra vid ekvivlenspunkten som en räkneteknisk förenkling för svaga syror och baser.
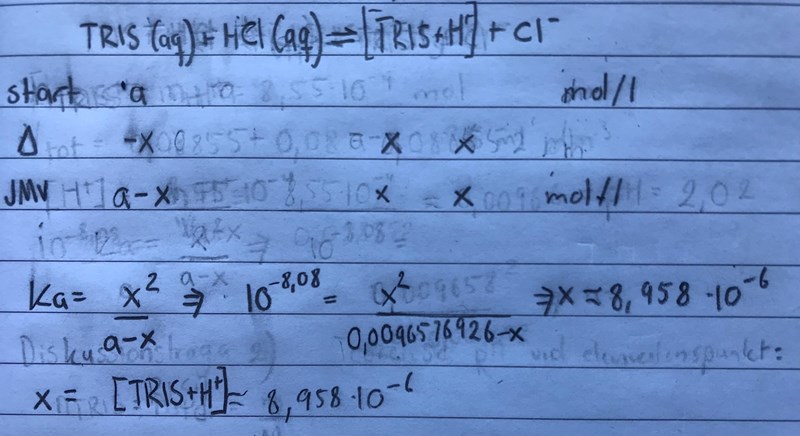
Den här tråden har blivit så rörig så att jag inte klarar av den längre - låt den här tråden handla om lösningen med HCl och tris och inga andra blnadningar.
Tillägg: När jag nu räknar om x med a som koncentration får jag x till ungefär 9,120*10^-5. pH-värdet blir 4,04. Jag hade emellertid vetat resonera att ''a-x'' motsvarar koncentrationen tris som inte har reagerat med fria vätejoner. Eftersom den är ekvivalent med koncentrationen vätejoner borde ''a-x'' avgöra pH-värdet. Om jag nu bara räknar -log[x] som jag har gjort får jag koncentrationen [TRIS+H+]. Detta säger inget om pH. Hoppas du förstår mig!
Är du med på att om man löser a mol tris och a mol HCl i samma lösning, så blir resultatet detsamma om om man hade löst upp a mol av saltet "tris-H-klorid", d v s det salt som man får om man låter tris reagera med ekvivalent mängd saltsyra?
Är du med på att när detta salt reagerar med vatten, så frigörs det ekvivalenta mängder av tris och oxoniumjoner?
Jag anser att uppgfiten har blivit löst just nu. Det första inlägget (vi kallar den försök 1) handlar om 15 ml 0,10 M HCl (aq) som reagerar med motsvarande mängd TRIS. Där beräknar jag pH till 4.04 men det jag reflekterade över varför man räknade med att all TRIS att tillbakabildas från sin korresponderande syra vid just ekvivlenspunkten. Det kändes som en ''två-stegs-reaktion'' och inget som sker i en punkt. Nu förstår jag att man gör så av beräkningstekniksa skäl.
I det andra försöket där jag har bifogat lösningar (vi kallar den försök 2) har man låtit 0,1036 g 0,013 M TRIS lösas i 80 ml vatten och gjort en titrering med saltsyra. Där beräknar jag pH till ungeför 5,05 (se den ''blåaktiga'' bilden). I de vita papprerna/de andra bilderna gör jag försök till lösningar som visar sig bli fel.
men det jag reflekterade över varför man räknade med att all TRIS att tillbakabildas från sin korresponderande syra vid just ekvivlenspunkten. Det kändes som en ''två-stegs-reaktion'' och inget som sker i en punkt. Nu förstår jag att man gör så av beräkningstekniksa skäl.
Precis! "av beräkningstekniska skäl" var en bra formulering, den skall jag komma ihåg.
I det andra försöket där jag har bifogat lösningar (vi kallar den försök 2) har man låtit 0,1036 g 0,013 M TRIS lösas i 80 ml vatten och gjort en titrering med saltsyra. Där beräknar jag pH till ungeför 5,05 (se den ''blåaktiga'' bilden). I de vita papprerna/de andra bilderna gör jag försök till lösningar som visar sig bli fel.
Här måste du räkna med koncentrationer, inte substansmängder. Volymen ändras ju vid titreringen. I den första uppgiften tillsattes ju fast tris, och det är så pass lite att vi inte behövde ta hänsyn till att volymen ändrades.


