Termodynamik
Hej, behöver hjälp med att ta fram värmen som går in i gasen. I min lösning (längst ner i bild) så har jag börjat med att utnyttja första lagen i termodynamiken . Men hur beräknar jag ?
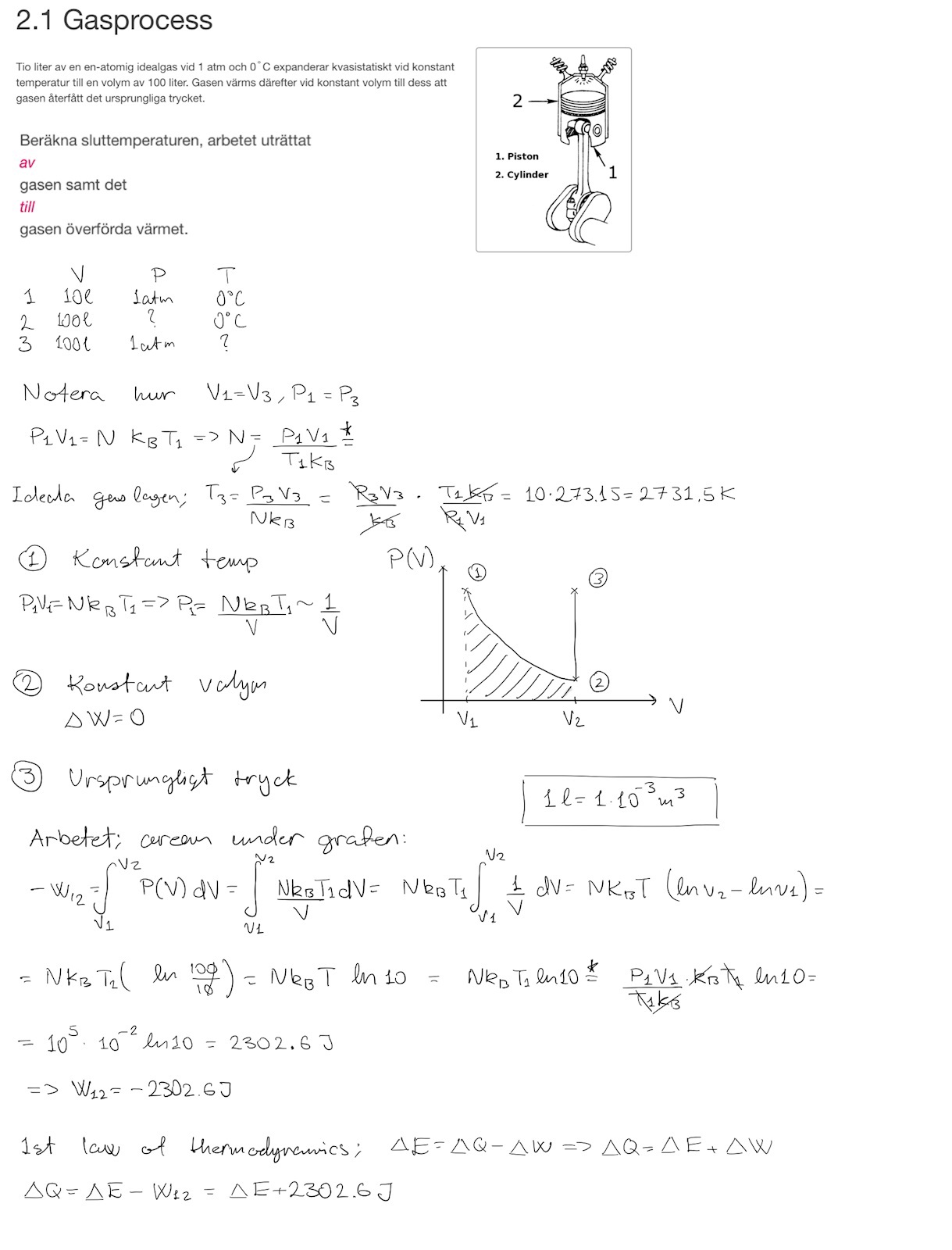
Jag ser inte att du har bestämt trycket vid (2).
Pieter Kuiper skrev:Jag ser inte att du har bestämt trycket vid (2).
Jag gör det nu.
Cien skrev:hur beräknar jag ?
Intern energi av en ideal gas beror endast på temperatur.
Pieter Kuiper skrev:Cien skrev:hur beräknar jag ?
Intern energi av en ideal gas beror endast på temperatur.
Jag har lite svårt för att förstå skillnaden på energi , värme och arbete inom termodynamiken. För jag har fått veta att det inte är samma sak trots samma enhet, Joule.
Är det så att
Cien skrev:Är det så att
Absolut inte. (Eller bara isotermt då, endast vid ideal gas, och akta tecken.)
Av alla dessa är endast intern energi (betecknas med E eller med U) en tillståndsfunktion. Du ska nog läsa boken.
Pieter Kuiper skrev:Cien skrev:Är det så att
Absolut inte. (Eller bara isotermt då, endast vid ideal gas, och akta tecken.)
Av alla dessa är endast intern energi (betecknas med E eller med U) en tillståndsfunktion. Du ska nog läsa boken.
Längst ner i bild skrivs det ett minustecken, vet du vart det kommer ifrån? För följer inte detta från termodynamikens första lag , här kan vi sätta ty isothermal process, vilket medför att alltså positivt tecken.
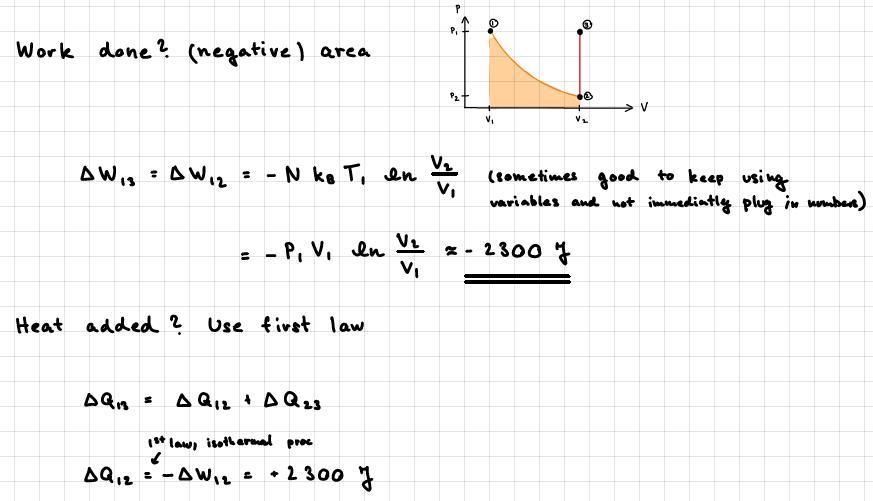
Cien skrev:Längst ner i bild skrivs det ett minustecken, vet du vart det kommer ifrån?
Är det från en video? Då förklaras det nog där.
(Ibland är arbetet W definierat som arbete av systemet, ibland som arbete på systemet.)
Pieter Kuiper skrev:Cien skrev:Längst ner i bild skrivs det ett minustecken, vet du vart det kommer ifrån?
Är det från en video? Då förklaras det nog där.
(Ibland är arbetet W definierat som arbete av systemet, ibland som arbete på systemet.)
Tack! (Anteckningar)


