Termodynamik 2
Jag behöver lite hjälp med att beräkna nedan. Är lite fundersam över att det är reversibelt, vi har ett V-P diagram istället för det vanliga P-V diagrammet. Jag försökte göra om det till ett PV diagram och sen räkna ut arbetet som arean under grafen. Får , det rätta svaret är . Slutvolymen och sluttemperaturen har jag beräknat korrekt.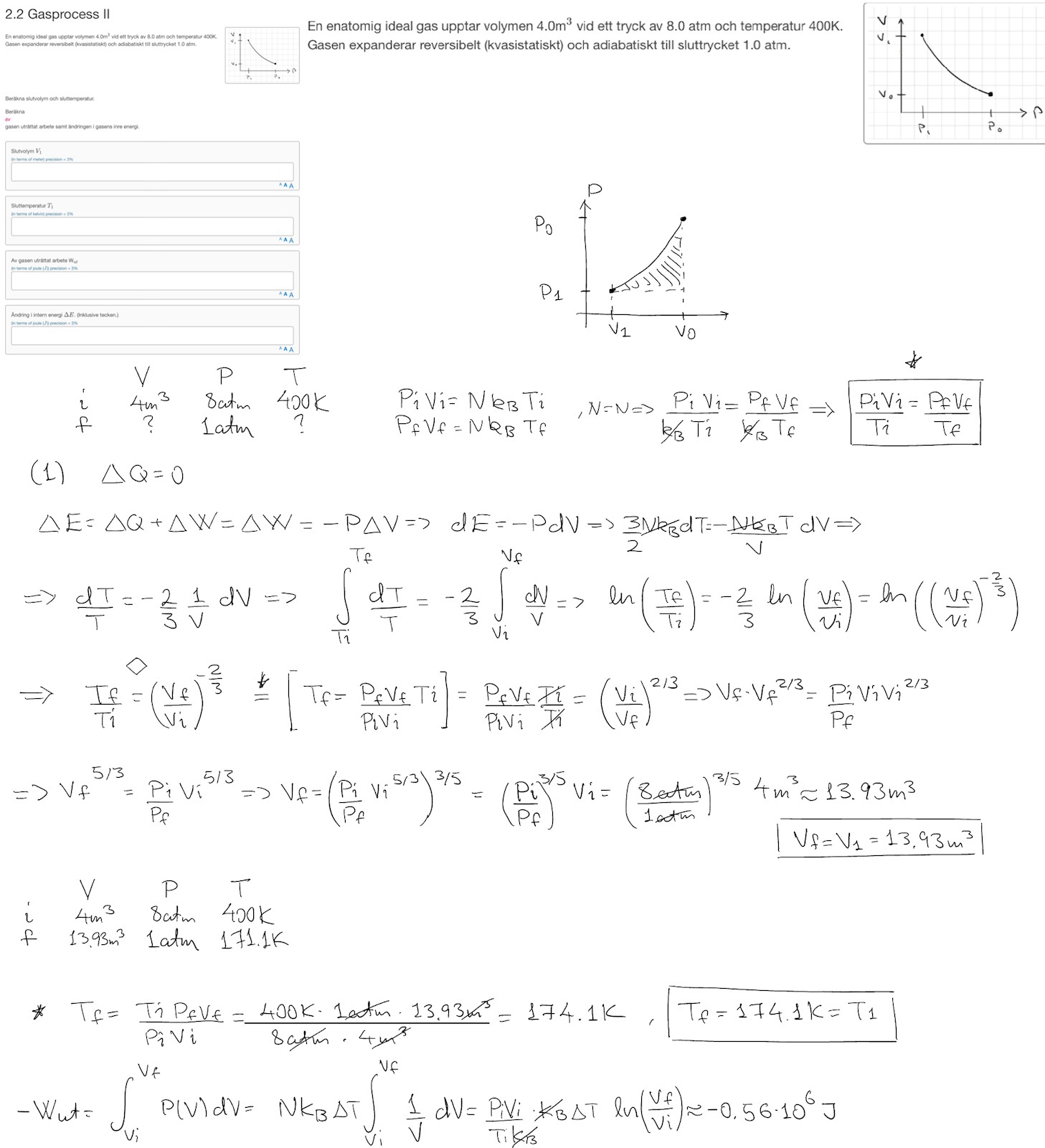
Cien skrev:vi har ett V-P diagram istället för det vanliga P-V diagrammet. Jag försökte göra om det till ett PV diagram och sen räkna ut arbetet som arean under grafen.
Ska det inte bli samma area? Jag mistänker något mattefel. Du kan ju kolla genom att räkna rutor.
(Och det står i uppgiften att det är reversibelt.)
Tillägg: enklaste metoden är att räkna ut skillnaden i intern energi.
Pieter Kuiper skrev:Cien skrev:vi har ett V-P diagram istället för det vanliga P-V diagrammet. Jag försökte göra om det till ett PV diagram och sen räkna ut arbetet som arean under grafen.
Ska det inte bli samma area? Jag mistänker något mattefel. Du kan ju kolla genom att räkna rutor.
(Och det står i uppgiften att det är reversibelt.)
Tillägg: enklaste metoden är att räkna ut skillnaden i intern energi.
Jag vet inte vad T ska vara (markerat i rött)
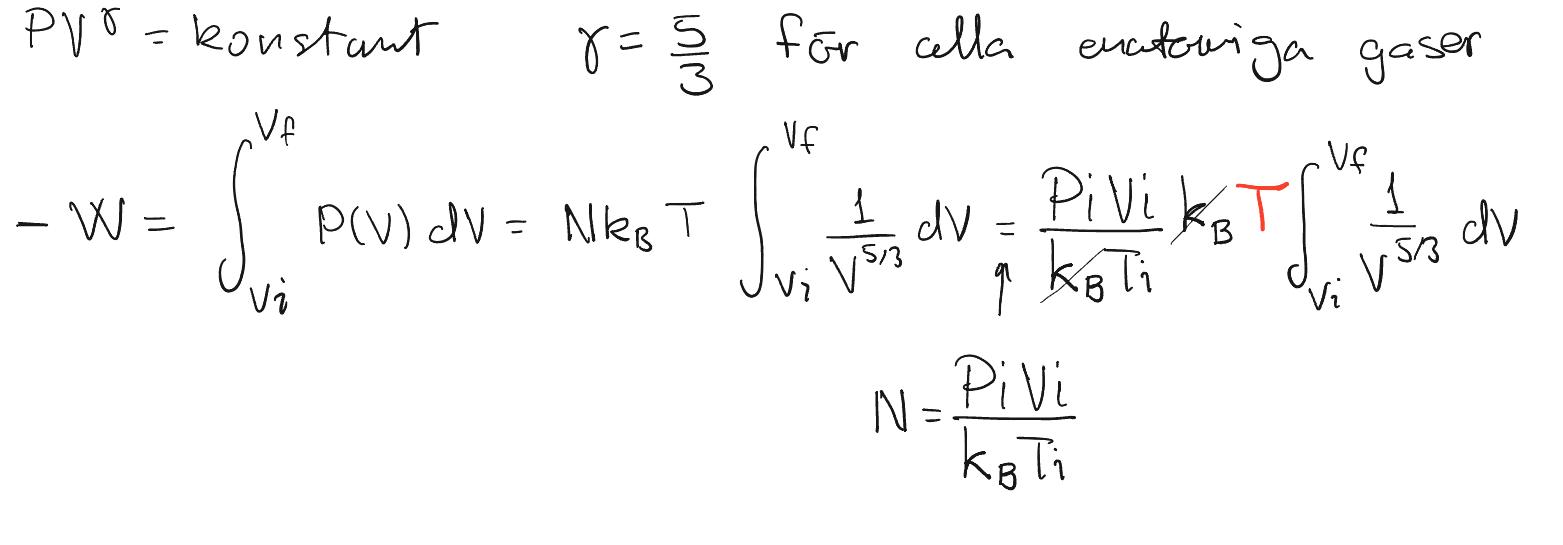
Cien skrev:Pieter Kuiper skrev:
Tillägg: enklaste metoden är att räkna ut skillnaden i intern energi.Jag vet inte vad T ska vara (markerat i rött)
Du skrev att du hade räknat ut temperaturen korrekt.
Pieter Kuiper skrev:Cien skrev:Pieter Kuiper skrev:
Tillägg: enklaste metoden är att räkna ut skillnaden i intern energi.Jag vet inte vad T ska vara (markerat i rött)
Du skrev att du hade räknat ut temperaturen korrekt.
Jo men vet inte om jag ska använda temperaturen före () eller efter (), eller kanske skillnanden i temperatur ()?
Det var en adiabat, så arbetet är lika med skillnaden i intern energi. För en ideal gas beror den endast på temperatur.
Pieter Kuiper skrev:Det var en adiabat, så arbetet är lika med skillnaden i intern energi. För en ideal gas beror den endast på temperatur.
Ja jag är med på att , men vad ska jag stoppa in för T i post #3 är jag inte med på.
Tillägg: 16 nov 2023 18:38
Jag vet att
Cien skrev:Pieter Kuiper skrev:Det var en adiabat, så arbetet är lika med skillnaden i intern energi. För en ideal gas beror den endast på temperatur.
Ja jag är med på att , men vad ska jag stoppa in för T i post #3 är jag inte med på.
Jag vet bara att gasen börjar på 400 kelvin. Räkna ut vilken intern energi den mängden gas har.
Du skrev att du hade räknat ut sluttemperaturen.
Integralerna kan du skita i.
Pieter Kuiper skrev:Cien skrev:Pieter Kuiper skrev:Det var en adiabat, så arbetet är lika med skillnaden i intern energi. För en ideal gas beror den endast på temperatur.
Ja jag är med på att , men vad ska jag stoppa in för T i post #3 är jag inte med på.
Jag vet bara att gasen börjar på 400 kelvin. Räkna ut vilken intern energi den mängden gas har.
Du skrev att du hade räknat ut sluttemperaturen.
Integralerna kan du skita i.
Inte gjort detta förut men är det ?
Cien skrev:Inte gjort detta förut men är det ?
Du räknar kinetisk energi per atom där. Typ 50 meV.
Pieter Kuiper skrev:Det var en adiabat, så arbetet är lika med skillnaden i intern energi. För en ideal gas beror den endast på temperatur.
Jag har försökt uttrycka vad jag vet om intern energi, har du någon synpunkt på detta uttalande?
Till en början har partiklarna i gasen en viss kinetisk energi. Partiklarna krockar mot väggarna och trycker ut. Detta tryck som förflyttar väggen kan förknippas med F*dx som är arbete -> volymen expanderar. En viss del av partiklarnas kinetiska energi går åt för att utföra detta arbete, dvs den interna energin minskar och förlusten har använts till att utföra arbetet.
Det uppgiften frågar efter är arbetet och ändringen av intern energi.
Varför inte räkna ut intern energi vid 400 kelvin? Och vid sluttemperaturen (som du redan har räknat ut).
Du verkar gilla integraler, men det behövs inte här. Du ska vid dessa två temperaturer räkna ut den interna energin av den här gasen som är där n är antalet mol, så det är n som återstår att bestämma.
Visa spoiler
Pieter Kuiper skrev:Det uppgiften frågar efter är arbetet och ändringen av intern energi.
Varför inte räkna ut intern energi vid 400 kelvin? Och vid sluttemperaturen (som du redan har räknat ut).
Du verkar gilla integraler, men det behövs inte här. Du ska vid dessa två temperaturer räkna ut den interna energin av den här gasen som är där n är antalet mol, så det är n som återstår att bestämma.Visa spoiler
Stämmer detta, vid 400K: Ei=4.86*10^6J, vid 171,1K: Ef=2.1*10^6J
Cien skrev:Stämmer detta, vid 400K: Ei=4.86*10^6J, vid 171,1K: Ef=2.1*10^6J
Det stämmer i alla fall med facit.
Pieter Kuiper skrev:Cien skrev:Stämmer detta, vid 400K: Ei=4.86*10^6J, vid 171,1K: Ef=2.1*10^6J
Det stämmer i alla fall med facit.
Det stämmer nu. Skillnaden är den totala interna energin. Tack!


