Termokemi, beräkna värdet på delta H per mol upplöst kalciumklorid
Jag har löst detta tal med mycket hjälp av facit och förstår det mesta men inte allt. Därav har jag några frågor om varför man gör vissa saker i facit uträckningen. Nedan ligger bilder på uppgiften och facit bifogat, mina frågor är skrivna under bilderna.

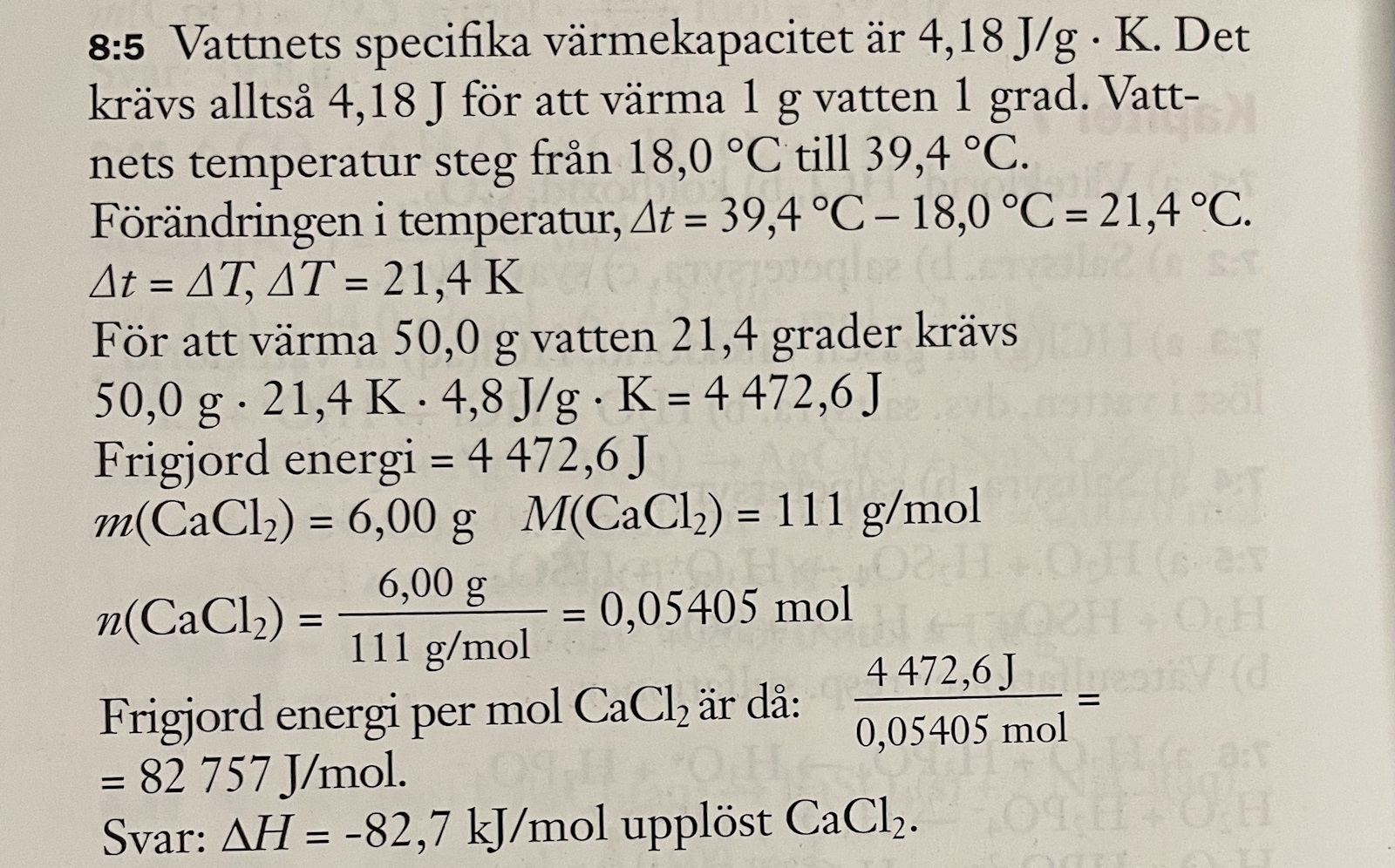
Frågorna är:
1. K i detta fall står väl inte för Kelvin, utan för vad? Om det står för Kelvin hur kan 21,4 grader Celsius då vara lika med 21,4 K.
2. Hur vet man hur man räknar ut den frigjorda energin finns det en formel? i så fall vilken?
3. På min miniräknare blev 4472,6J/0,05405mol= 82749,3J/mol hur blir 9 på slutet av decimalen 7 och inte noll? hur avrundar dem?
4. Varför blir det ett minustecken framför svaret? hur vet man att man ska lägga till det?
Tack på förhand (:
1. Det står för Kelvin. Man tar en genväg som fungerar eftersom skillnaden mellan två temperaturer är lika stor i Kelvin som i grader Celsius.
2. Ja, formeln man använder är
3. Man har troligen tagit med alla decimaler för substansmängden i facit medan du räknar med det avrundade värdet.
4. Temperaturen stiger, vilket betyder att processen är exoterm. En exoterm process har ett negativt tecken eftersom värme per definition anges som det värme som flödar IN i systemet. I detta fall är det värme som flödar ut ur systemet, vilket ger ett negativt värde.


