Titrering av svag syra med stark bas
Jag sitter och arbetar med en labrapport med hjälp av en laborationsvideo som Hermods har för distanskurserna och jag har kört fast lite. Jag har sett andra trådar behandla samma laboration och jag kan inte annat än hålla med om att videon inte ger det bästa underlaget.
Ättiksyra med sagda koncentrationen 0,100 mol/dm^3 titreras med NaOH 0,100 mol/dm^3 och man får pH-värdet vid varje tillsatt cm^3 NaOH. Ekvivalenspunkten har jag fått luska ut på måfå med hjälp av min graf jag ritat upp i kalkylblad eftersom de värden som togs var pH 7,01 vid 19 cm^3 tillsatt NaOH och pH 10,67 vid 20 cm^3 tillsatt NaOH. Det gick åt 19,5 cm^3 NaOH för 20 cm^3 ättiksyra. Kurvan ser rimlig ut och den sagda koncentrationen på ättiksyran får jag till 0,0965 mol/dm^3 istället för den sagda 0,100 mol/dm^3.
Men när jag sedan skall undersöka halvtitrerpunkten så blir jag konfunderad, jag läser av den vid halva mängden tillsatt NaOH och där är pH cirka 5,63 vilket om jag förstått rätt skall ge mig syrakonstanten på ättiksyran och jag får det till 2,34* 10^-06 men den syrakonstant som står för ättiksyra i boken är Ka 1,8*10^-5 och pKa 4,76 vilket jag förstår det som att då borde halvtitrerpunkten vara där pH-värdet är 4,76? Det är helt orimligt eftersom pH innan titreringen börjar är 4,08.
Experimentet utförs i en vanlig sal så då bör ju listan med syrakonstanter vara rimlig eftersom den visar värdena för rumstemperatur. Har jag totalmissat något här? Syrakonstanten ändrar väl sig inte beroende på syrans koncentration? Jag bifogar hur min titrerkurva ser ut också, den är som sagt lite ryckig men jag har använt de värden som var i videon. 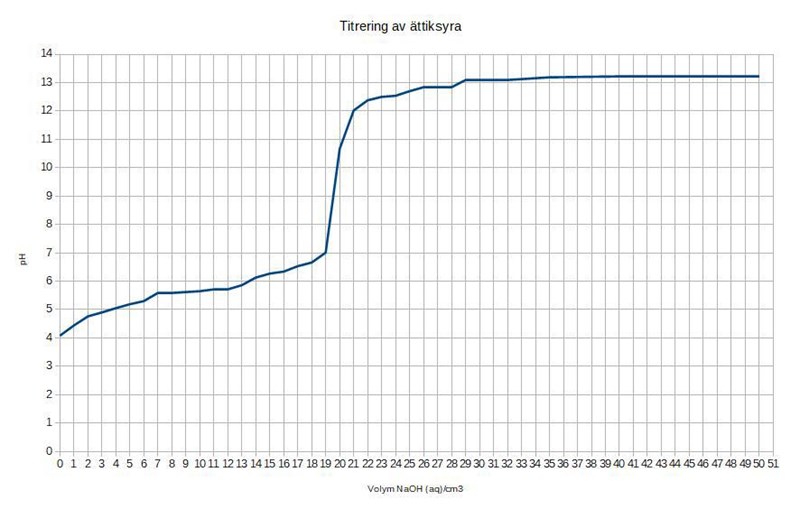
Enligt den här titrerkurvan är syrakonstanten ungefär 5,6.
Smaragdalena skrev:Enligt den här titrerkurvan är syrakonstanten ungefär 5,6.
Då har jag läst av kurvan rätt eftersom jag läste av pH när hälften hade tillsatts om jag förstår rätt.
Då får det mig att fundera på om det ens är ättiksyra som titreras men det är ingen annan konstant som matchar den som kurvan visar. Jag har även kikat runt på videor där det räknas med hjälp av syrakonstanten med hjälp av ekvationer men jag vet inte hur jag skall använda svaren för att sammanfatta något vettigt att skriva.
Jag kan bara komma på två förklaringar: antingen är det inte ättiksyra, eller så är pH-metern väldigt felkalibrerad.
Smaragdalena skrev:Jag kan bara komma på två förklaringar: antingen är det inte ättiksyra, eller så är pH-metern väldigt felkalibrerad.
Det skulle förklara väldigt mycket, tack för hjälpen!
Hej!
Första gången jag skriver något här så rätta mig gärna om något blir galet.
Jag har precis som ovanstående medlem sökt information på flertalet andra trådar här angående exakt samma uppgift som ovan.
Även jag har kört fast på uppgiften då Ka för ättiksyra (1,810-5) inte motsvarar Ka som man får fram via titrerkurvan, pH 5,65 10-5,65 ≈ 2,2410-6
Känns som jag har missat något eller kan det vara så att det är en felkälla!?
Med Vänlig Hälsning
Jessica
Frågan är om man kan förvänta sig en så mycket bättre noggrannhet i den här typen av experiment. Om jag vore du hade jag försökt att räkna på hur stor skillnaden blir i praktiken.
Säg att du har ättiksyra med koncentrationen 0,1 mol/dm3 som i denna uppgift. Hur högt pH skulle den lösningen ha om man räknar med ditt Ka respektive referens-Ka? Du kan sen jämföra detta med lösningens uppmätta pH vid titreringens start.
Tillägg: 29 mar 2023 15:44
Välkommen till Pluggakuten förresten!
Ett tips är att i framtiden skapa en ny tråd och länka till den gamla tråden. Det är många som låter bli att öppna gamla trådar, så det kan ta längre tid att få hjälp jämfört med om du skapar en egen tråd.
Tack för snabbt svar då ska jag kika på skillnaden, och Tack för information angående ny tråd.
Med Vänlig Hälsning
Jessica



