Titrering med precision
Jag har läst runt lite på andra trådar och förstår inte riktigt hur alla löser resultat delen.
Det är en webblabbration vi får se och utgå ifrån. Jag förstår inte hur man löser uppgiften riktigt, med värdena jag får hur gör jag kurvan? Och och hur bestäms ekvivalenspunkten därefter? Jag märker att de flesta har olika värden från min webblabbration så antagligen kan jag ju inte utgå efter deras beräkningar, min fråga är mest hur sätter jag in det till att få ett tresiffrigt värde i syrorna samt hur får jag fram ekvivalenspunkten?
Det är omöjligt att svara på frågan när vi inte har någon bakgrundsinformation.
Om du går in under inlägget titrering med precision kommer det finnas ett inlägg där någon bifogat, vet själv inte hur man gör det tyvärr däremot kan jag bifoga mina värden om du förstått uppgiften
Hade varit evigt tacksam om någon kan vägleda mig lite då jag verkligen inte kommer nånstans
Som du kan se detta är mina värden till vänster står det mängden NaOH som tillsattes samt till höger står det pH värdet efter varje ml som blivit tillsätts. Hur går jag tillväga nu? Hur räknar jag ut ekvivalanspunkten?
Ekvivalenspunkten ligger i mitten av ”hoppet”, vilket ser ut att ligga efter att typ 19,5 ml NaOH-lösningen hade blivit tillsatt, dvs vid ungefär pH 8. Eftersom pH-värdet vid ekvivalenspunkten är högre än 7 (neutralt) vet man också att det var en svag syra som titrerades. Om man titrerar en stark syra med en stark bas kommer ekvivalenspunkten att ligga vid pH 7 istället.
Utifrån detta kan du, givet att du känner till NaOH-lösningens koncentration, räkna ut hur många mol NaOH som tillsattes. Om syran var enprotonig fanns det lika många mol från början i lösningen du titrerade.
Behöver det inte vara exakt själva antalet ml av NaOH som tillsätts för själva ekvivalenpunkten, är det inte någon slags uträkning som görs på de? eller kan man se sånt med ögat? Förstår inte hur det är man går tillväga
HCI (aq) + NaOH (aq) → H2O (I) + NaCI (aq)
Substansmängdförhållande: 1:1:1:1 → n(HCI) = n(NaOH)
V(HCI)= 0,020 dm upphöjt till 3
c(HCI) = ?
V(NaOH) = 0,0195 dm upphöjt till 3
C(NaOH) = 0,100 mol/dm upphöjt till 3
n (NaOH) = c(NaOH) x V(NaOH) = 0,100 mol/dm (upphöjt 3) x 0,0195 = 0,00195 mol →
n(HCI)= 0,00195 mol
c(HCI) = n(HCI) / V(HCI) = 0,00195 mol / 0,020 dm(upphöjt 3) = 0,0975 mol/dm (upphöjt 3)
Har jag tänkt rätt vad gällande den andra uträkningen
sarandras skrev:Behöver det inte vara exakt själva antalet ml av NaOH som tillsätts för själva ekvivalenpunkten, är det inte någon slags uträkning som görs på de? eller kan man se sånt med ögat? Förstår inte hur det är man går tillväga
Nej, syftet med att göra en kurva är att kunna läsa av ekvivalenspunkten. Man gör ingen uträkning för det.
sarandras skrev:HCI (aq) + NaOH (aq) → H2O (I) + NaCI (aq)
Substansmängdförhållande: 1:1:1:1 → n(HCI) = n(NaOH)
V(HCI)= 0,020 dm upphöjt till 3
c(HCI) = ?V(NaOH) = 0,0195 dm upphöjt till 3
C(NaOH) = 0,100 mol/dm upphöjt till 3
n (NaOH) = c(NaOH) x V(NaOH) = 0,100 mol/dm (upphöjt 3) x 0,0195 = 0,00195 mol →
n(HCI)= 0,00195 mol
c(HCI) = n(HCI) / V(HCI) = 0,00195 mol / 0,020 dm(upphöjt 3) = 0,0975 mol/dm (upphöjt 3)Har jag tänkt rätt vad gällande den andra uträkningen
Det ser rätt ut, men jag hade inte gissat att det var saltsyra som titrerades eftersom ekvivalenspunkten ser ut att ligga över pH 7 och saltsyra är en stark syra. Men det var bara en parentes...
Däremot skrivs inte saltsyra som HCI utan HCl (litet L, inte stort i). Cl som i den kemiska beteckningen för klor.
På motsvarande sätt skrivs aggregationstillståndet för vatten med ett litet L, dvs (l). Det står för liquidus (vätska på latin).
Det är just det jag sitter och funderar på värdena jag fick fram är för den starka syran HCl men hur kommer det sig då att pH värdet är över 7?
Det ligger ju inte jättehögt över 7 och det finns alltid felkällor när man gör en sån här undersökning. Om du upprepade titreringen några gånger kanske medelvärdet skulle ligga närmre 7.
Detta resultatet fick jag när jag hade svag syra vad är ekvivalenpunkten här då? Så som jag ser det tog det fart vid 19,5 här också kan det stämma att de sker vid båda försöken?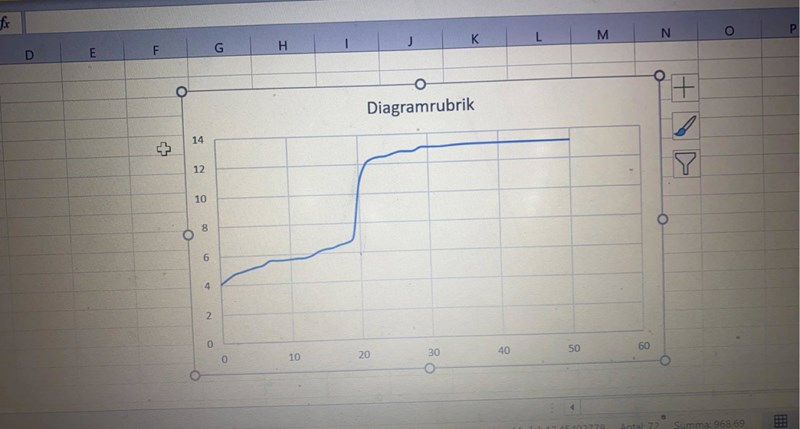
Det verkar så.


