Titrering med precision
Hej!
Jag har några uträkningar till en labbrapport som jag är osäker på.
Här kommer instrutionerna:


Detta är titrerkurvan jag gjort utifrån värden på pH och mängd tillförd NaOH-lösning från deras labortaionsfilm: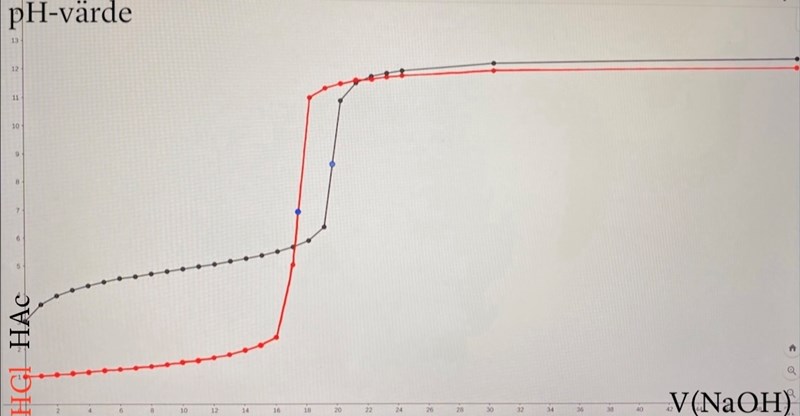
V(HCl) = 20 ml
Jag börjar med uträkning av koncentratin av salsyra(röd graf).
NaOH (aq) + HCl (aq) -> H2O (l) + NaCl (aq)
1mol NaOH (aq) = 1 mol HCl (aq)
EP = 7 då HCl är en stark syra
V(NaOH) = 17,3*10-3 dm3 vid EP
n(NaOH) = n(HCl) = c*V = 0.100 mol/dm3 * 17,3*10-3 dm3 = 1.73*10-3 mol
c(HCl) = = = 0.0865 mol/dm3
Ser jag ut att beräknat koncentartionen rätt, är svaret rimligt utifrån min titrerkurva?
Nu räknar jag ut det exakta pH-värdet för HCl:
c(HCl) =[H3O+] = 0.0865 mol/dm3
pH = -lg(0.0865) = 1.063
Stämmer mina beräkningar hittills?
Visst kan jag inte räkna ut ett Ka- värde för HCL då den är en stark syra och fullständigt protolyserad i vattnet?
(postar mina beräkningar för HAc då funderingarna ovan klarnat)
Det finns lika många mol syra i 20 ml HCl som det finns bas i 17,3 ml NaOH så koncentrationen av HCl är lite lägre än koncentrationen av NaOH, så det verkar stämma.
Det övriga ser också rimligt ut. När det är en stark syra är beräknaingarna enkla.
Okej, tack så mycket för svar!
Stämmer det jag skrev om ett Ka- värde för HCl?
"att det inte är möjligt att räkna ut då HCl är en stark syra och är då fullständigt protolyserad"
Är det rätt att tänka såhär?:
c(HCl) =[H3O+] = 0.0865 mol/dm3
pH = -lg(0.0865) = 1.063
Det som bekymrar mig är att pH-värdet jag räknat ut här är samma pH-värde som efter en tillsats av 2 ml NaOH-lösning vid titreringen, kan mitt värde stämma ändå?
karlsson12 skrev:Okej, tack så mycket för svar!
Stämmer det jag skrev om ett Ka- värde för HCl?
"att det inte är möjligt att räkna ut då HCl är en stark syra och är då fullständigt protolyserad"
Det stämmer - om man skulle försöka skulle man ju dividera med 0 och det kan man inte göra. (Det finns andra metoder som gör att man kan jämföra olika starka syror med varandra, men det är på universitetsnivå.)
Är det rätt att tänka såhär?:
c(HCl) =[H3O+] = 0.0865 mol/dm3
pH = -lg(0.0865) = 1.063
Det som bekymrar mig är att pH-värdet jag räknat ut här är samma pH-värde som efter en tillsats av 2 ml NaOH-lösning vid titreringen, kan mitt värde stämma ändå?
Hur mycket oxoniumjoner finns det kvar när man har tillsatt 2 ml NaOH? Vilket pH borde lösningen ha då? När man titrerar en stark syra med en (lagom koncentrerad) stark bas så ändras pH-värdet ganska lite förrän man närmar sig ekvivalenspunkten.
Okej det låter rimligt!
Hm, så pH-värdet jag räknade ut här är korrekt, alltså att jag antog att c(HCl) = [H3O+] ?
Ja. Kan det vara så att pH-metern inte var riktigt kalibrerad, om den inte visar det pH-värde den borde ha visat?
Ja, det är mycket möjligt. Som sagt så tittade jag på en video där en av mina lärare utförde titreringen.
Här kommer mina uträkningar för ättiksyra, den svarta grafen i diagrammet.
Koncentration av HAc:
HAc (aq) + NaOH (aq) → NaAc (aq) + H₂O (l)
vilket leder till att 1 mol HAc (aq) ⇌ 1 mol NaOH(aq)
EP(HAc) ≈ 8.754 enligt diagrammet jag gjort
V(NaOH) ≈ 19.498*10⁻³ dm³ vid EP
n(HAc) = n(NaOH) = c*V = 0.100 mol/dm³*19.498*10⁻³ dm³ ≈ 1.9498*10⁻³ mol
c(HAc) =n(HAc)V(HAc)=1.9498*10⁻³ mol20.0*10⁻³ dm³ ≈ 0.09749 mol/dm³
Uträkningen för koncentrationen ovan är jag ganska säker på!
Jag undrar endast om pH-värdet för EP(HAc) är rimligt?
Exakta pH-värdet för HAc:
c(HAc) = [H₃O⁺] = 0.09749 mol/dm³
pH = -lg(0.09749) ≈ 1.0110
pH-värdet jag räknat ut ovan är väldigt orimligt då pH-värdet för HAc innan titreringens början var 3.01(se titrerkurvan i diagrammet i första inlägget), vad har jag gjort fel?
Du kan själv räkna ut om pH-värdet är rimligt. Vid EP är lösningens sammansättning likadan sm om du hade löst upp 1,9498.10⁻³ mol NaAc i 39,5 ml vatten. Använd dig av Kb för att acetatjonen för att beräkna pH. Vet du hur du skall göra detta? Det är i alla fall rimligt att pH är basiskt vid EP.
pH-värdet jag räknat ut ovan är väldigt orimligt då pH-värdet för HAc innan titreringens början var 3.01(se titrerkurvan i diagrammet i första inlägget), vad har jag gjort fel?
Du har räknat som om HAc vore en stark syra. Vet du hur du skall beräkna pH i en lösdnin av en svag syra?
Nej tyvärr vet jag inte hur jag ska göra för att räkna ut det exakta pH-värdet för HAc som är en svag syra.
Jag vet inte heller hur jag ska göra för att räkna ut om pH vid EP är rimligt med hjälp av Kb för acetatjonen.
Hittade denna formel för att kunna bestämma koncentrationen av oxoniumjoner för att sedan kunna räkna ut pH-värdet.
Ka=
Räknar till en början därför ut syrakonstanten.
Ka för HAc:
V(NaOH) vid halvtitrerpunkten = 19.498*10⁻³ dm³/2 = 9.749 *10⁻³ dm³
pH-värdet vid halvtitrerpunkten = 4.8974
Ka = Då [HAc] = [Ac⁻] blir = 1 → Ka = [H₃O⁺]
[H₃O⁺] = 10-4.8974 mol/dm³ ≈ 1.266*10-5 mol/dm³
Ka- värdet för HAc är 1.8*10-5 mol/dm³ vid 25℃ enligt min lärobok, är mitt uträknade Ka- värde för HAc rimligt och rätt uträknat? Kan Ka-värdet för en svag syar skilja sig åt som jag i mitt fall fått fram?
Att volymen för NaOH vid halvtitrerpunkten är 9,749 dm5 är orimligt, om du menar dm3 och helt obegripligt om du verkligen menar decimeter upphöjt till 5.
Du borde visa i titrerkurvan var man hittar pKa-värdet.
Ursäkta, det ska vara 9.749 *10⁻³ dm³.
pKa-värdet återfinns halvvägs till ekvivalenspunkten:
Den gröna punkten på grafen för HAc visar koordinaterna för pKa-värdet alltså vid pH= 4.89774 och vid V(NaOH) =9.749 *10⁻³ dm³, se diagram nedan.
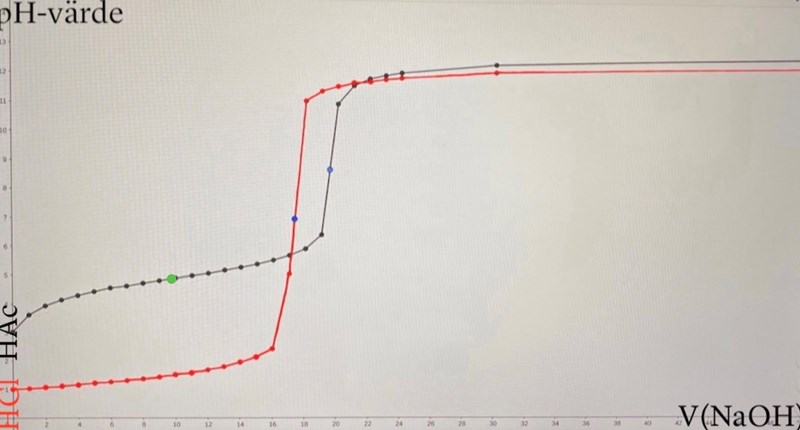
karlsson12 skrev:Ursäkta, det ska vara 9.749 *10⁻³ dm³.
pKa-värdet återfinns halvvägs till ekvivalenspunkten:
Den gröna punkten på grafen för HAc visar koordinaterna för pKa-värdet alltså vid pH= 4.89774 och vid V(NaOH) =9.749 *10⁻³ dm³, se diagram nedan.
Vad är dm5 för konstig enhet?
Det vet jag inte, jag skulle skriva dm3 med det blev lite fel, ber om ursäkt för det.
karlsson12 skrev:Hittade denna formel för att kunna bestämma koncentrationen av oxoniumjoner för att sedan kunna räkna ut pH-värdet.
Ka=
Räknar till en början därför ut syrakonstanten.
Ka för HAc:
V(NaOH) vid halvtitrerpunkten = 19.498*10⁻³ dm³/2 = 9.749 *10⁻³ dm³pH-värdet vid halvtitrerpunkten = 4.8974
Ka = Då [HAc] = [Ac⁻] blir = 1 → Ka = [H₃O⁺]
[H₃O⁺] = 10-4.8974 mol/dm³ ≈ 1.266*10-5 mol/dm³
Ka- värdet för HAc är 1.8*10-5 mol/dm³ vid 25℃ enligt min lärobok, är mitt uträknade Ka- värde för HAc rimligt och rätt uträknat? Kan Ka-värdet för en svag syar skilja sig åt som jag i mitt fall fått fram?
Har jag gjort denna uträkning rätt? :)
Om du har läst av pH vid halvtitrerpunkten rätt (vilket jag inte kan se på bilden, eftersom graderingen är så otydlig) verkar det vettigt.
Okej, tack för hjälpen!
Räknade sedan ut det exakta pH-värdet frö HAc innan titreringens början:
Exakta pH-värdet för HAc:
Ka = x*x[HAc]-x
1.266*10-5=x*x0.09749-x
1.266*10-5(0.09749-x) = x2
x2+ 1.266*10-5x - 1.23422*10-6= 0
x1=0.00111096 x2=- 0.00111096 svaret x2förkastas då de är negativt
[H₃O⁺]= x1= 0.00111096 → pH = -lg(0.00111096) ≈ 3.954
Mitt uträknade pH-värde är 3.96 och pH-värdet jag fick innan titreringen börjades m.h.a. en pH-meter är pH-värdet = 3.01.
Hur kommer det sig att dom skiljer sig så mycket förutsatt att jag gjort min beräkningar rätt?
Ka = x*x[HAc]-x
Vad är det här för konstig formel? Definitionen är , d v s Ka=x2/(1,3.10-5-x) om x är vätejonkonentrationen.
Ja exakt ska stå Ka =
Edit av mitt inlägg:
Ka =
1.266*10-5=
1.266*10-5(0.09749-x) = x2
x2+ 1.266*10-5x - 1.23422*10-6= 0
x1=0.00111096 x2=- 0.00111096 svaret x2 förkastas då de är negativt
[H₃O⁺]= x1= 0.00111096 → pH = -lg(0.00111096) ≈ 3.954
Mitt uträknade pH-värde är 3.96 och pH-värdet jag fick innan titreringen börjades m.h.a. en pH-meter är pH-värdet = 3.01.
Hur kommer det sig att dom skiljer sig så mycket förutsatt att jag gjort min beräkningar rätt?
Varifrån har du fått värdet 0,09749?
Hur många mol HAc var det från början? Vilken volym har lösningen vid halvtitrerpunkten? Vilken skulle koncentrationen av HAc ha varit, om syran inte hade protolyserats alls?
Värdet 0.09749 kommer från c(HAc) = 0.09749 mol/dm³
Ska jag inte sätta in värdet för syrans koncentration i formeln?
Nu har tråden blivit så lång att det har blivit rörigt, och jag är inte säker på vad det är vi försöker räkna ut. Är det pH innan vi började titrera ättiksyran? I så fall verkar det vara rätt koncentration du sätter in. Jag kan ha varit ute och cyklat tidigare.
Ja exakt, jag vill få fram det exakta pH-värdet för HAc innan titreringens början!
Jag gör en ny tråd så det blir enklare att se vilken info som är relevant osv. :)


