RonyaF skrev:vad menas med teoretiska beräkningar?
det står ju inte vad exakt det är vi ska räkna ut?
RonyaF, du har redan blivit tillsagd att inte bumpa din tråd förrän tidigast efter 24 timmar. Om du fortsätter att bryta mot Pluggakutens regler riskerar du att bli avstängd./moderator
Jo, visst står det: Beräkna det teoretiska pH-värdet om man löser upp 0,824 g NaOH i 2 dm3 vatten, beräkna (den teoretiska) koncentrationen för vinsyra om pH = 2,4 respektive beräkna det teoretiska pH värdet om man löser upp 5,6025 g vinsyra löses i 1 dm3 vatten.
Smaragdalena skrev:RonyaF, du har redan blivit tillsagd att inte bumpa din tråd förrän tidigast efter 24 timmar. Om du fortsätter att bryta mot Pluggakutens regler riskerar du att bli avstängd./moderator
Jo, visst står det: Beräkna det teoretiska pH-värdet om man löser upp 0,824 g NaOH i 2 dm3 vatten, beräkna (den teoretiska) koncentrationen för vinsyra om pH = 2,4 respektive beräkna det teoretiska pH värdet om man löser upp 5,6025 g vinsyra löses i 1 dm3 vatten.
Ville bara förtydliga att jag inte fattade om det som ska räknas ut står med eller inte:)
Men vad menas med teoretisk? Och om det är vad jag ska räkna ut, hur räknar jag ut det? är det inte bara Ka jag kan få ut av att ha pH värde för en syra?
Om du har något att tillägga, bör du redigera ditt inlägg, inte bumpa det. /moderator
Ett teoretiskt värde är ett som du räknar fram med hjälp av Ka-värdet (gäller inte den starka basen hydroxidjon).
Om du löser upp a mol av en svag syra i vatten så protolyseras den, och vid jämvikt finns det x mol oxoniumjoner, x mol av den konjugerade basen till syran och a-x mol syra. Om du vet två av värdena Ka, x och a kan du beräkna det tredje.
Behöver du mer hjälp, så visa hur långt du har kommit och fråga igen.
Har jag gjort rätt hittills? Ska få ut X för att ta reda på mängd oxoniumjoner men sen da? ska få ut koncentrationen oxoniumjoner för att sedan få ut pH värdet men är volymen 2 kubimdecimeter?
Börja med att skriva en korrekt formel för vad som händer när man löser upp NaOH, som innehåller den starka basen hydroxidjon, i vatten. Det bildas definitivt inte några oxoniumjoner.
Smaragdalena skrev:Börja med att skriva en korrekt formel för vad som händer när man löser upp NaOH, som innehåller den starka basen hydroxidjon, i vatten. Det bildas definitivt inte några oxoniumjoner.
Ja jag tänkte väl att det är en ganska stark bas och att det bildas Na+ och OH-! Men då blir det väl inte pH utan pOH? Eller kan man skriva pH till bägge? Och är resten rätt? eller var jag helt ute och cyklade?
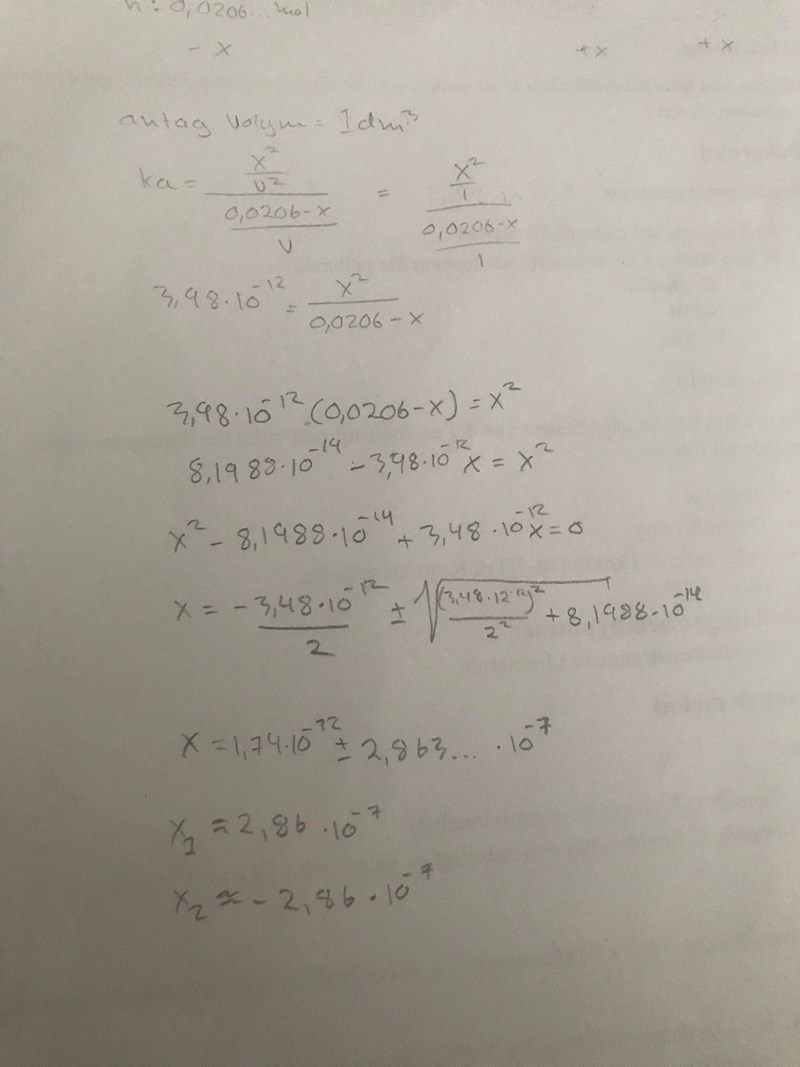 detta kom jag fram till X2 är en falsk rot så alltså borde x vara 2,86*10^-7
detta kom jag fram till X2 är en falsk rot så alltså borde x vara 2,86*10^-7
Hur räknar jag ut koncentrationen för ett ämne där jag bara har volymen och lösningens uppmätta pH-värde??
Volymen är 20ml som då är 0,02dm^3
har även Ka för syran! Kan någon ge tips på hur jag kan påbörja lösningen till uppgiften? har hållit på med den i en timme nu och får inga rimliga värden! Help me:(
Visa hur du har försökt, så kan vi hjälpa dig vidare.
Om du löser upp a mol av en svag syra i vatten så protolyseras den, och vid jämvikt finns det x mol oxoniumjoner, x mol av den konjugerade basen till syran och a-x mol syra. Om du vet två av värdena Ka, x och a kan du beräkna det tredje.
Du vet ju Ka, och eftersom du har pH kan du beräkna x.
Smaragdalena skrev:Visa hur du har försökt, så kan vi hjälpa dig vidare.
Om du löser upp a mol av en svag syra i vatten så protolyseras den, och vid jämvikt finns det x mol oxoniumjoner, x mol av den konjugerade basen till syran och a-x mol syra. Om du vet två av värdena Ka, x och a kan du beräkna det tredje.
Du vet ju Ka, och eftersom du har pH kan du beräkna x.
Ja det var ungefär så jag gjorde men kom inte fram till något svar... Här va mitt försök 
10-3 är lika med 0,001, inte 0,01 som du har räknat med.
Smaragdalena skrev:10-3 är lika med 0,001, inte 0,01 som du har räknat med.
svaret blir ju fortfarande negativt
Visa hur du räknar - vi är inte några tankeläsare som kan veta hur du har tänkt när du bara säger "svaret blir ju fortfarande negativt",
Smaragdalena skrev:Visa hur du räknar - vi är inte några tankeläsare som kan veta hur du har tänkt när du bara säger "svaret blir ju fortfarande negativt",
Ändrade alla 0,01 till 0,001 och då fick jag att koncentrationen är 0,75mol/dm^3! Vet inte om min beräkning är rätt men det låter som ett rimligt svar och det borde ändå vara en rätt beräkning så tack för hjälpen!



