Trommers Prov, redox-reaktioner, fruktos, laktos
Jag har förstått att glukos reduceras eftersom den har en aldehydgrupp som gör att den kan reduceras enkelt. den reduceras i kolatom 1, sackaros gör inte det då den är uppbyggd av en glukosmolekyl och en fruktosmolekyl där glukus kolatom 1 och fruktos kolatom 1 redan är "upptagna" och då försvinner möjligheten att reduceras helt.
det jag inte förstår är varför fruktos reducerars när den har en ketongrupp?
jag förstår inte heller varför laktos reduceras även fast den är en disackarid?
Det här med reducerande sockerarter är mycket riktigt lite mystiskt: vid första anblicken ser det ju faktiskt ut som att ingen av de klassiska vardags-sockerarterna är reducerande!
Först och främst: vad krävs för att en sockerart ska vara reducerande?
Jo, den måste precis som du skriver innehålla en aldehydgrupp. En sådan kan avge elektroner till de blå koppar(II)jonerna som finns närvarande vid Trommers prov, så att det bildas en karboxylsyra och röda koppar(I)joner enligt följande reaktionsformel:

Låt oss nu börja med att fundera över det prototypiska exemplet på en reducerande sockerart: glukos, som har följande strukturformel:
Inte en aldehydgrupp så långt ögat kan nå! Så hur kommer det sig att glukos är reducerande? Som du redan verkar ha lite koll på, så beror det på att i vattenlösning så är ca. 1 % av glukosringarna alltid öppna, och i den där öppna formen finns det en aldehydgrupp på kolatom nummer 1. Man säger att man har en kemisk jämvikt mellan de två formerna, så här:
Även om bara är 1 % av glukosmolekylerna som befinner sig i den här öppna aldehydformen, så är det tillräckligt många för att det ganska snabbt ska börja bildas lite röd koppar(I). Och i takt med att de öppna glukosmolekylerna börjar ta slut, så kommer reaktionen ovan att gå åt höger, så att "förådet" av öppna glukosmolekyler "fylls på", så att det i varje givet ögonblick alltid finns ca. 1 % öppen glukos.
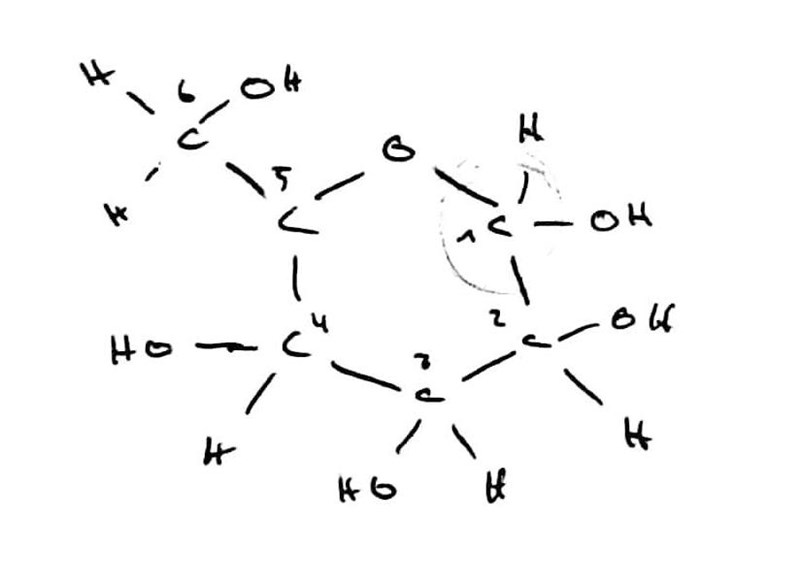
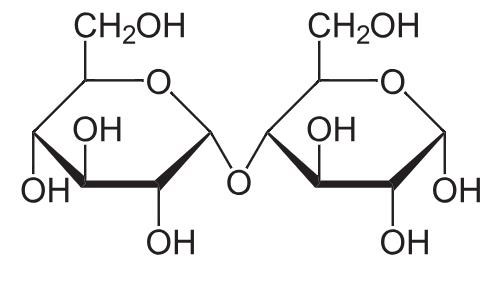
Nästa exempel vi kan kolla på är maltos, som är en disackarid som påminner lite om laktos. Jag orkade inte rita egna figurer för just laktos, men hittade bra bilder för maltos, så du får hålla till godo med det i stället! (Fundera gärna på vad skillnaden mellan maltos och glukos är, och om denna skillnad spelar någon viktig roll i förklaringen!)
På Wikipedia finns följande förenkade strukturformel (varje "hörn" i hexagonerna motsvarar en kolatom och en extra väteatom):
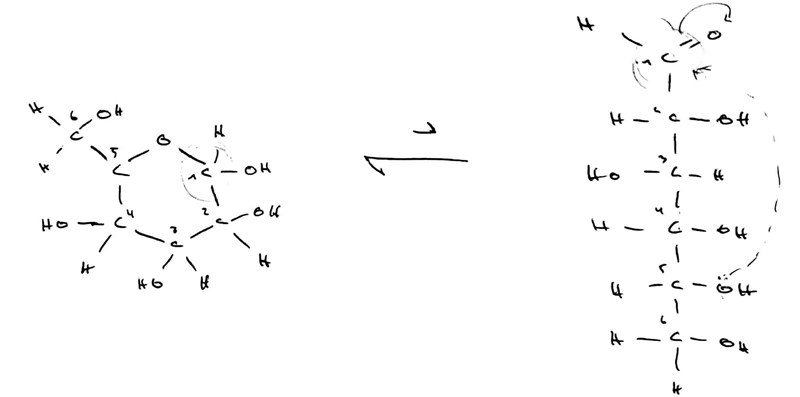
Återigen, inga aldehydgrupper i sikte, men precis som glukos har maltos en liten tendens att öppna sig i den högre änden, så att en aldehydgrupp uppkommer:
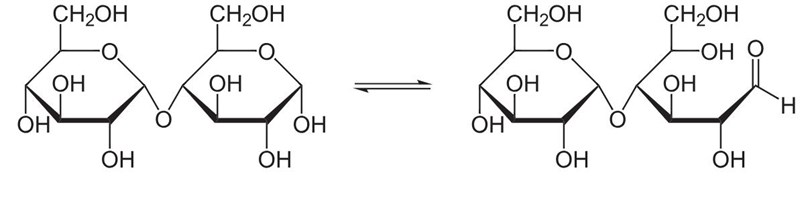
Det är värt att notera, precis som du har gjort, att sackros är ihopsatt på att sådant sätt att molekylen inte kan öppna upp sig.
Slutligen kan vi ta en titt på fruktos, som är ännu ett snäpp mer mystisk. Precis som andra cykliska sockerarter så kan fruktos öppna upp sig i vattenlösning på det här sättet:
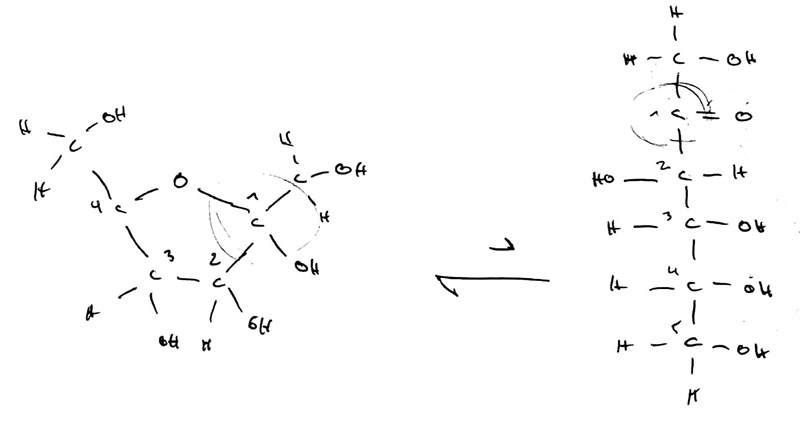
Men inte ens då dyker det upp en aldehydgrupp, utan (precis som verkar ha koll på) en ketongrupp, och sådana går i allmänhet inte att reducera på samma sätt som aldehyder.
Men just i basisk miljö (såsom vid Trommers prov) har fruktosmolekylen ytterligare ett trick i rockärmen som den kan använda. Den kan nämligen kasta om vätejoner och elektronpar mellan atomerna i änden av molekylen på ett sådant sätt att den dubbelbundna syreatomen byter plats men en OH-grupp! (De små pilarna i strukturformeln indikerar hur elektronparen flyttar på sig under reaktionens gång; mer om detta får du lära dig om du läser Kemi 2 på gymnaiset.)
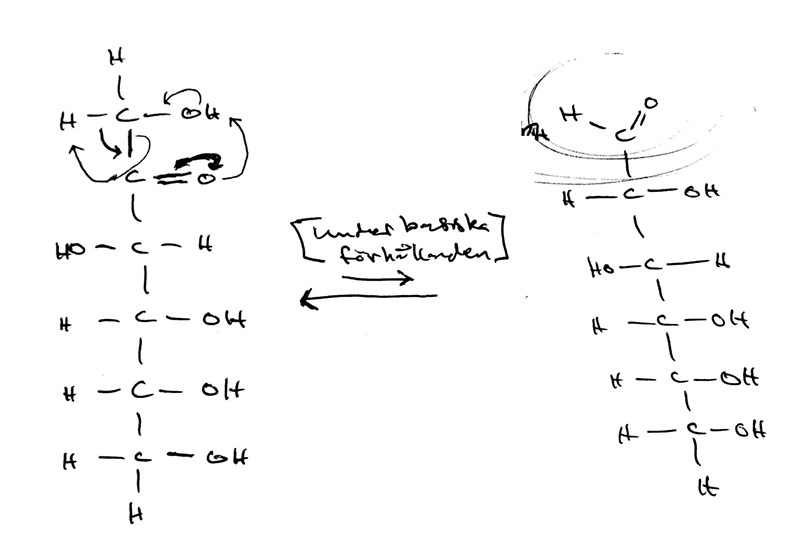
Detta är en mycket ovanlig "förklädnad" för fruktos (jag skulle tro att det bara är några enstaka promille av molekylerna som befinner sig i aldehydformen, medan >99% av molekylen befinner sig i antingen någon form av cyklisk from eller ketonformen), men några promille räcker, och allteftersom aldehydformen förbrukas under reaktionen så kommer "förådet fyllas på" så att reaktionen kan fortsätta, och till slut har det bildats tillräckligt mycket röda koppar(I)joner för att det ska synas i provröret! (Mer om så kallade "jämviktsreaktioner" kommer också i Kemi 2 på gymnasiet!)
Hoppas du känner att detta blev lite klarare! Om inte, eller om du har följdfrågor är det bara att säga till, så hjälper jag eller någon annan här gärna dig vidare!
tack för infon! har verkligen hjälpt.
jag undrar nu om laktos är som glukos, maltos och laktos och inte alltid är öppen vid den funktionella gruppen? eller är det bara i tex vattenlösning?
I ren, fast form förekommer enbart den slutna så kallade hemiacetalformen ("hemiacetal "är ett fint ord för en aldehyd som har reagerat med en OH-grupp). Detta gäller såväl glukos som maltos och laktos.
I vattelösning öppnar sig en del (max någon enstaka procent skulle jag tro) av ringarna sig så som bilderna i mitt förra inlägg visar. Detta gäller såväl glukos som maltos och laktos.
Varför händer detta bara i vattenlösning kan man fråga sig? Svaret ligger delvis i att "ringöppningsreaktionen" kräver att vätejoner hoppar fram och tillbaka mellan de inblandade syreatomerna i ett antal olika steg (mer om detta om du läser kemi på universitetet!), och för att detta ska kunna ske effektivt behövs omgivnade vattenmolekyler som kan fungera som en slags "vätejonsbank" som sockret först kan låna en vätejon av, och sedan lämna tillbaka en vätejon till.
Var det svar på din fråga?


