Uppgift om molaritet för blandning.

Från fråga a) fick jag den balanserade reaktionsformeln som blev:
Sedan ritade jag upp de två bägarna  Förstår inte riktigt hur jag ska hitta "n1" och "n2" i uppgiften, jag har testat att ställa upp sambandet
Förstår inte riktigt hur jag ska hitta "n1" och "n2" i uppgiften, jag har testat att ställa upp sambandet
Eftersom volymen är lika stor i de två lösningarna. Men det leder mig ingenstans. Jag antar att koncentrationen hydroxidjoner kommer innehålla 2*n1 för att det bara finns 2 hydroxidjoner i reaktionsformeln. Skulle uppskatta en knuff i rätt riktning.
Anta att du börjar med 1 liter , så innehåller det 0,05 mol hyrdroxidjoner. Till det tillsätter du en liter, alltså 0,04 mol H+, som reagerar med hyrdroxidjoner till vatten.
Kvar är därmed 0,01 mol hydroxidjoner. Det finns nu i 2 liter (en liter från varje lösning). Därmed....
Zockimon skrev:Anta att du börjar med 1 liter , så inneholler det 0,05 mol hyrdroxidjoner. Till det tillsätter du en liter, alltså 0,04 mol H+, som reagerar med hyrdroxidjoner till vatten.
Kvar är därmed 0,01 mol hydroxidjoner. Det finns nu i 2 liter (en liter från varje lösning). Därmed....
Då sätter man väl bara in alla värden i , vilket jag gör genom:
Detta var något jag prövade lite senare men verkade ändå vara fel svar eftersom det står följande i facit: 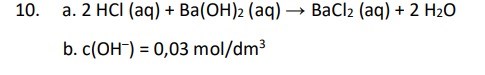
Zockimon har gått vilse på första raden, troligen p g a fel formel för Ba(OH)2.
Hur många mol hydroxidjoner finns det i 1 liter lösning om totalhalten av bariumhydroxid är 0,05 mol/dm3?
Hur många mol oxoniumjoner finns det i 1 liter lösning om totalhalten av HCl är 0,04 mol/dm3?
Kommer lösningen att bli sur eller bssisk?
Smaragdalena skrev:Zockimon har gått vilse på första raden, troligen p g a fel formel för Ba(OH)2.
Hur många mol hydroxidjoner finns det i 1 liter lösning om totalhalten av bariumhydroxid är 0,05 mol/dm3?
Hur många mol oxoniumjoner finns det i 1 liter lösning om totalhalten av HCl är 0,04 mol/dm3?
Kommer lösningen att bli sur eller bssisk?
För Ba(OH)2:
Eftersom det finns två OH molekyler gissar jag att man tar , alltså 0.1 mol hydroxidjoner
För HCl:
Det bildas en oxoniumjon i HCl vilket då innebär att man använder det ursprungliga molvärdet man fick i den senaste molberäkningen, 0.04mol oxoniumjoner.
Om jag utgår från det Zockimon skrev tidigare, att reaktion sker med hydroxidjonerna antar jag att man subtraherar antalet hydroxidjoner med antalet oxoniumjoner: , ifall det är sant kan man bara ställa upp sambandet
som matchar svaret i facit. Var beräkningen korrekt?
Smaragdalena skrev:Zockimon har gått vilse på första raden, troligen p g a fel formel för Ba(OH)2.
Hur många mol hydroxidjoner finns det i 1 liter lösning om totalhalten av bariumhydroxid är 0,05 mol/dm3?
Hur många mol oxoniumjoner finns det i 1 liter lösning om totalhalten av HCl är 0,04 mol/dm3?
Kommer lösningen att bli sur eller bssisk?
Tack! Ja, varit blind :)
Ja, nu är det rätt. Men det finns inga "OH molekyler" - molekyler är alltid oladdade, och hydroxidjonerna är just juner, d v s de är laddade.
Toppen, tack!


