Vad är det i arenernas sätt att vara, som gör de till: canser framkallande, miljögifter dylikt?
Står så här: många giftiga ämnen i tobaksrök & även många miljögifter är arener.
Toulen ger dessutom svåra hjärnskador. Och finns i bensin.
En liten följdfråga kopplad till det här, hur ser det ut idag med bensen i bensin, någon som vet?
Om du hade slagit upp benzene på engelska Wikipedia hade du kunnat läsa det där.
Enligt engelska Wikipedia är bensen, toluen och xylen mer värdefulla som råvara för den kemiska industrin, så det är nog inte så värst mycket bensen i bensin. Jag blev förvånad när jag såg att det är så mycket som 35 % aromater i bensin.
Solstråle skrev:
Vad är det i arenernas sätt att vara, som gör de till: canser framkallande, miljögifter dylikt?
Jag kan egentligen väldigt lite om toxikologi, så någon får gärna korrigera mig nu, men en kvalificerad gissning är att farligheten i arener är en kombination av dels det faktumet att att arener är opolära (och därmed blir svåra att utsöndra eftersom de gärna håller sig i fettvävnader och andra opolära miljöer i kroppen), och dels att vår metabolism är dåligt anpassat för att hantera arener, eftersom aromatiska kolväten är ovanliga i naturen.
Risken är därför stor att vi inte lyckas bli av med arenerna om vi får in dem i kroppen, utan att de börjar ackumuleras på olika ställen och ställer till med större och större problem, och vad värre är: när metabolismen angriper arenerna med den vanliga "arsenalen" av verktyg som vi har för att oskadliggöra främmande molekyler, så kan det hända konstiga saker som bara förvärrar situationen.
Detta verkar vara ett av huvudproblem när det kommer till just bensen, som är den enklaste arenen. Ett av de vanligaste tricken kroppen använder för att bli av med opolära molekyler är oxidation, eller mer konkret: att trycka in så mycket syreatomer som möjligt tills molekylen är tillräckligt polär för att följa med ut i urinen. Detta är ofta en helt okej strategi, men för bensen är det katastrofalt.
Här är en (förenklad) bild av ungefär vad metabolismen hittar på med bensen (bildkälla: https://www.researchgate.net/figure/Benzene-metabolism-in-the-liver-and-bone-marrow-Benzene-metabolism-in-the-liver-by_fig1_10874416):
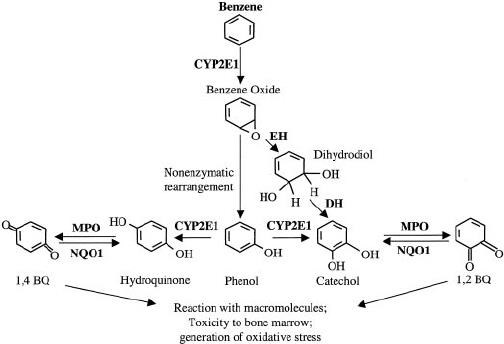
Lägg märke till molekylerna längst ner till höger och vänster, som kallas för bensoquinoner. De är betydligt mer polära än bensen, och har därför större chans att utsöndras (vilket är bra!), men de starkt elektonegativa syrena kommer tyvärr samtidigt att interagera med de kvarvarande dubbelbindningarna i kolringen på ett sätt som gör dem extremt elektrofila, och risken är därför stor att de här elektronhungriga monstren i sin jakt på elektroner kommer hinna reagera med viktiga biomolekyler i kroppen, och på vis skapa alla möjliga sorters biokemiskt kaos. Som jag förstår det tros detta kaos vara en viktig anledning till att bensen är rejält cancerframkallande.
När det gäller andra arener kan liknande saker hända (bildgoogla gärna på valfri aren + metabolism, och se om du får upp några intressanta förslag på tänkbara metabolismvägar). För just toluen finns dock en lite förmildrande omständighet, i och med att om den första oxidationen äger rum på metylgruppen, så kan man till slut få bensoesyra som produkt, som är jämförelsevis väldigt ogiftigt (det förekommer naturligt i bland annat lingon, och är en vanligt konseveringsmedel i mat) och som kroppen kan ta hand om på ett bra sätt - men med det sagt är toluen så klart inte alls bra att få i sig.
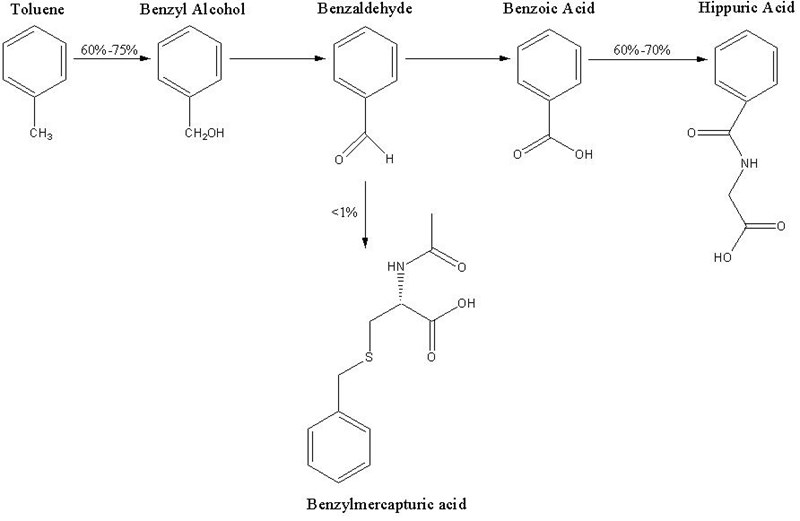
Här ett diagram från Wikipedia:
Jätte tack, för en brilliant svar, det är ganska fashinerande med med kemikalier som de där lite extra egenskaperna även om de ställer till det, med samtidigt är en av de vanligaste råvara för andra viktiga ting vi har vardaglig använding av, så förmodligen, bara vi hanterar den på någonlunda smartsätt eller lär oss att neutralisera det, så lär vi kunna leva på den här planeten sida vid sida med miljögifter, så länge vi har koll på dem och deras mekanismer.
oggih skrev:Solstråle skrev:
Vad är det i arenernas sätt att vara, som gör de till: canser framkallande, miljögifter dylikt?
Jag kan egentligen väldigt lite om toxikologi, så någon får gärna korrigera mig nu, men en kvalificerad gissning är att farligheten i arener är en kombination av dels det faktumet att att arener är opolära (och därmed blir svåra att utsöndra eftersom de gärna håller sig i fettvävnader och andra opolära miljöer i kroppen), och dels att vår metabolism är dåligt anpassat för att hantera arener, eftersom aromatiska kolväten är ovanliga i naturen.
Risken är därför stor att vi inte lyckas bli av med arenerna om vi får in dem i kroppen, utan att de börjar ackumuleras på olika ställen och ställer till med större och större problem, och vad värre är: när metabolismen angriper arenerna med den vanliga "arsenalen" av verktyg som vi har för att oskadliggöra främmande molekyler, så kan det hända konstiga saker som bara förvärrar situationen.
Detta verkar vara ett av huvudproblem när det kommer till just bensen, som är den enklaste arenen. Ett av de vanligaste tricken kroppen använder för att bli av med opolära molekyler är oxidation, eller mer konkret: att trycka in så mycket syreatomer som möjligt tills molekylen är tillräckligt polär för att följa med ut i urinen. Detta är ofta en helt okej strategi, men för bensen är det katastrofalt.
Här är en (förenklad) bild av ungefär vad metabolismen hittar på med bensen (bildkälla: https://www.researchgate.net/figure/Benzene-metabolism-in-the-liver-and-bone-marrow-Benzene-metabolism-in-the-liver-by_fig1_10874416):
Lägg märke till molekylerna längst ner till höger och vänster, som kallas för bensoquinoner. De är betydligt mer polära än bensen, och har därför större chans att utsöndras (vilket är bra!), men de starkt elektonegativa syrena kommer tyvärr samtidigt att interagera med de kvarvarande dubbelbindningarna i kolringen på ett sätt som gör dem extremt elektrofila, och risken är därför stor att de här elektronhungriga monstren i sin jakt på elektroner kommer hinna reagera med viktiga biomolekyler i kroppen, och på vis skapa alla möjliga sorters biokemiskt kaos. Som jag förstår det tros detta kaos vara en viktig anledning till att bensen är rejält cancerframkallande.
När det gäller andra arener kan liknande saker hända (bildgoogla gärna på valfri aren + metabolism, och se om du får upp några intressanta förslag på tänkbara metabolismvägar). För just toluen finns dock en lite förmildrande omständighet, i och med att om den första oxidationen äger rum på metylgruppen, så kan man till slut få bensoesyra som produkt, som är jämförelsevis väldigt ogiftigt (det förekommer naturligt i bland annat lingon, och är en vanligt konseveringsmedel i mat) och som kroppen kan ta hand om på ett bra sätt - men med det sagt är toluen så klart inte alls bra att få i sig.
Här ett diagram från Wikipedia:
Smaragdalena skrev:Jag blev förvånad när jag såg att det är så mycket som 35 % aromater i bensin.
Det har säkert delvis att göra med att de har höga oktantal, vilket innebär att de bör vara bra på att ta upp (syre)radikaler och stabilisera dem utan att det leder till fullständig förbränning. Jag är för trött för att fundera över ifall detta har någon koppling till oggihs inlägg och om det finns någon koppling mellan detta och det som händer i kroppen. Rätt intressant, dock.
Förbränningskemi är väldigt långt utanför det jag egentligen kan något om, men i väntan på att Teraeagle piggnar till, eller någon annan lite mer praktiskt lagd kemist kommer till undsättning, så kanske jag ändå kan få spekulera lite löst...
Skulle man kanske kunna tänka sig att aromatiska ämnen har högre aktiveringsenergi vid förbränning, i och med att vad-det-nu-än-är-som-händer vid (det hastighetsbestämmande steget vid en) förbränning antagligen kräver att aromaticiteten bryts, vilket blir en extra kostnad, jämfört med att "bara" bryta kovalenta bindningar som är fallet är ett icke-aromatiskt kolväte förbränns? Och den här förhöjda aktiveringsenergin bidrar kanske till att arenerna beter sig lite mer "lugnt" och "kontrollerat" i en förbränningsprocess, vilket väl typ hänger ihop med högt oktantal på något vis? Den formella definitionen av oktantal är rätt tekniskt formulerad, så jag har aldrig riktigt fattat vad det är oktantal "egentligen" är ett mått på, men aktiveringsenergi nämns i alla fall lite i förbigående på Wikipedia.
I en bensinmotor vill man att bränsle-syre-blandningen ska komprimeras när kolven trycks in i cylindern, sedan antändas av tändstiftet, vilket får gasblandningen att expandera och trycka ut kolven igen. När gasblandningen komprimeras finns det en risk att den självantänder innan tändstiftet aktiveras, vilket gör att motorn hamnar ur fas och ”knackar”. Oktantalet mäter ett ämnes förmåga att motstå en sådan självantändning, dvs man vill ha ett högt oktantal i en bensinmotor (till skillnad från i en dieselmotor där man saknar tändstift och faktiskt är ute efter självantändning, men då pratar man inte om oktantal utan om cetantal).
För att det inte ska ske någon självantändning gäller att kolvätena måste vara (relativt sett) bra på att motstå förbränning. En förbränningsprocess sker ju normalt i form av bildandet av radikaler som bildar nya radikaler, vilket ger nya radikaler osv i en kedjereaktion som dessutom är exoterm och frigör sin egen aktiveringsenergi.
Ämnen med höga oktantal har alltså på något sätt en förmåga att stabilisera radikalerna, dvs om ämnet reagerar med en radikal så blir den nya radikalen på något sätt mindre reaktiv. Kollar man på vilka ämnen som har höga oktantal så är det t.ex. alkener, arener, alkoholer och grenade alkaner. Som jag förstår det så är de mindre reaktiva p.g.a. möjligheten att sprida ut laddning över molekylen och möjlighet till resonans.
Som sagt: Det kanske är helt orelaterat till ämnenas giftighet, men det verkar inte helt orimligt att ett ämne blir skadligare om det är svårare att oxidera. Samtidigt så har ju alkoholer också höga oktantal och bildar ganska stabila radikaler, men alkoholer kan väl kroppen göra sig av med relativt enkelt. Samtidigt kanske det har en evolutionär förklaring i och med att alkoholer faktiskt, till skillnad från kolväten, är ganska vanligt förekommande i naturen.
Jag undrar ifall de finns någon skillnad i giftigheten hos alkaner, alkener/alkyner och arener? Rent allmänt så är ju omättade kolväten lättare att få att reagera, men de borde göra liknande typ av skada mot proteiner, cellmembran och liknande (eventuella skadeeffekter från oxidationsprodukterna enligt oggihs inlägg borträknade).
Sen tänker jag att faran delvis borde bero på var dessa reaktioner sker. Även om toluen bryts ner till ”harmlös” bensoesyra är den knappast harmlös om den omgående går ut i blodet och t.ex. orsakar acidos. Gissar att nedbrytningen sker i levern?




