Vad har en dipol för egenskaper?
Hej!
Jag undrar vad en dipol har för egenskaper? Jag vet vad en dipol är, jo en molekyl som inte är symmetrisk, men jag undrar varför man behöver veta om en molekyl är en dipol eller inte? Vad är skillnaden mellan en dipol och en icke dipol förutom att en dipol inte är symmetrisk och alltid består av polära kovalenta bindingar medan en icke dipol oftast består av opolära kovalenta bindningar (det finns vissa undantag förstås)?
Jag hoppas jag gjorde mig förstod! Tack på förhand!
Svaret finns i själva namnet ”dipol”.
”Di” är ett prefix som betyder två. Alltså betyder ”dipol” att det finns två poler. Med andra ord att molekylen har en positiv och en negativ ände vilket beror på det som du skrev angående polära bindningar och symmetri.
Det är viktigt eftersom polerna möjliggör att molekylerna kan attrahera varandra starkare än om molekylerna var helt opolära och bara kunde binda till varandra med svaga van der Waals-krafter. Kokpunkten för dipolära ämnen är alltså ganska hög. Dipolära ämnen är ofta lösliga i vatten eftersom vatten självt är en dipol och därför kan binda ganska bra till dessa ämnen.
Okej, är det så att dipoler endast kan lösa sig med dipoler, och icke dipoler endast kan lösa sig med icke dipoler?
Det finns alltid gränsfall - t ex kan etanol blanda sig både med vatten och med bensin.
Vad menar du med gränsfall? Att det finns några dipoler som både kan lösa sig med andra dipoler och icke dipoler? Finns det några vanliga sådana ämnen (förutom etanol som du nämnde ovan)?
Problemet med dipolsbegreppet är att det bara fungerar för små molekyler. Glukos är t.ex. en polär förening som är väldigt lättlöslig i vatten men jag skulle inte kalla det för en dipol. Man skulle kunna säga att det finns massor med små dipoler i glukos i form av alla hydroxigrupper.
Okej, men varför är det nödvändigt att veta om ett visst ämne är en dipol eller icke dipol? Vad för nytta kan man ha av det? Räcker det inte ifall man bara vet att ämnet består av polärt kovalenta bindningar eller opolärt kovalenta bindningar? (:
Nej, och du har egentligen redan svarat på det. Man måste veta ifall molekylen har polära kovalenta bindningar och om den är symmetrisk. Om den har polära bindningar och är osymmetrisk så innebär det att ämnet är en dipol. Konsekvensen av att ett ämne är en dipol är det som jag skrev i mitt tidigare inlägg - det påverkar ämnets kokpunkt (och smältpunkt) samt dess löslighet.
Teraeagle skrev:Nej, och du har egentligen redan svarat på det. Man måste veta ifall molekylen har polära kovalenta bindningar och om den är symmetrisk.
Varför måste man veta att den är symmetrisk? På vilket sätt påverkar symmetrin det polära ämnets förmåga? Vad är skillnaden på en icke dipol och en dipol med polärt kovalenta bindningar? Och vad är likheten mellan egenskaperna hos en icke dipol och en dipol med polärt kovalenta bindningar?
Om den har polära bindningar och är osymmetrisk så innebär det att ämnet är en dipol. Konsekvensen av att ett ämne är en dipol är det som jag skrev i mitt tidigare inlägg - det påverkar ämnets kokpunkt (och smältpunkt) samt dess löslighet.
Finns det någon tabell eller liknande där jag kan se hur ämnets kokpunkt, smältpunkt och löslighet påverkas av ämnen som är dipoler? Kräver dipoler högre kokpunkt och smältpunkt än ickedipoler, och är det svårare för en dipol att lösa sig i vätskor än för en icke dipol? Om ja, vad beror det på? (Jag gissar att det har att göra med att två atomer i en dipol har en starkare elektrisk laddning/dragning till varandra, men jag förstår inte hur och skulle uppskatta om någon förklarade det!)
Tack på förhand!
Det måste finnas ett dipolmoment för att ämnet ska bli en dipol.
Liknelse: tänk en dragkamp mellan en stark och en svag person. När de drar i varsin ände av repet så vinner den starka personen och kan dra repetet närmre sig själv. Så fungerar det i en dipol, där den starka personen motsvarar den mer elektronegativa atomen medan repet motsvarar bindningselektronerna.
Om du nu tänker dig att du har två lika starka personer på bägge sidor så kommer inte repet att flytta på sig. Det motsvarar en situation där man har två atomer med ungefär likadan elektronegativitet. Då får man ingen polär bindning vilket innebär att molekylen inte kan bli en dipol.
Symmetriregeln skulle ungefär motsvara att man har tre personer bredvid varandra med en svag person i mitten och två starka på sidorna. Personen i mitten håller ett rep i vardera hand som de två starka personerna drar i. Även fast personerna på kanterna är mycket starkare än personen i mitten så rör sig inte repen eftersom krafterna balanserar varandra. Personerna på sidorna drar lika mycket åt motsatta håll vilket gör att den svaga personen i mitten står still (nåja...). Det motsvarar ungefär situationen i koldioxid där man har en kolatom i mitten och två syreatomer på vardera sida i linje med kolatomen (bildgoogla om du inte vet hur molekylen ser ut).
Man kan också tänka sig en situation där personerna inte står bredvid varandra utan där de starka personerna kanske stå bredvid varandra och drar i repen. Då balanserar inte krafterna varandra längre och den svagare personen orkar inte stå emot. Det motsvarar ett exempel där molekylen inte är symmetrisk och denna kraftsituation skulle man på kemispråk kalla för dipolmoment. Molekylen blir då en dipol. Detta skulle kunna motsvara situationen i vatten (fast då det snarare den starka personen som står i mitten, så liknelsen haltar lite...).
Och vad är likheten mellan egenskaperna hos en icke dipol och en dipol med polärt kovalenta bindningar?
Menar du att både icke-dipolen och dipolen har polära kovalenta bindningar? De har nog inte fler likheter annat än att de till skillnad från t.ex. salter eller metaller bildar molekylära ämnen. Men det är inte betydelselöst att molekylen har polära kovalenta bindningar även fast den inte är en dipol. Det sker ju fortfarande en laddningsuppdelning i molekylen som har betydelse för t.ex. ämnets benägenhet att reagera med andra ämnen.
Finns det någon tabell eller liknande där jag kan se hur ämnets kokpunkt, smältpunkt och löslighet påverkas av ämnen som är dipoler?
Det finns så många ämnen där ute så det skulle bli en jättestor tabell. Men man kan ju jämföra snarlika molekyler för att påvisa skillnaden. Jämför t.ex. egenskaperna hos metan och metanol.
Åhh, tack så mycket!!!!
Teraeagle skrev:Och vad är likheten mellan egenskaperna hos en icke dipol och en dipol med polärt kovalenta bindningar?
Menar du att både icke-dipolen och dipolen har polära kovalenta bindningar?
Inte alla icke dipoler, men vissa icke dipoler som t.ex. glykol har polära kovalenta bindningar.
De har nog inte fler likheter annat än att de till skillnad från t.ex. salter eller metaller bildar molekylära ämnen. Men det är inte betydelselöst att molekylen har polära kovalenta bindningar även fast den inte är en dipol. Det sker ju fortfarande en laddningsuppdelning i molekylen som har betydelse för t.ex. ämnets benägenhet att reagera med andra ämnen.
Hur påverkas ämnets benägenhet att reagera med andra ämnen om den är en icke dipol med polärt kovalenta bindningar, jämfört med om den är en icke dipol med opolärt kovalenta bindningar?
Glykol är ett ganska klurigt exempel eftersom det blir en dipol beroende på hur man ritar ut OH-grupperna. Om de ligger på samma sida så får man en dipol, men om de ligger på motsatta sidor får man åtminstone en svagare dipol. I verkligheten så kan ju OH-grupperna rotera fritt runt molekylen. Men man kan betrakta själva OH-grupperna i sig som små dipoler som lätt kan skapa bindningar (vätebindningar) till vatten eller varandra och därför blir glykol blandbart med vatten och har en hög kokpunkt. Så du ser att redan för en så pass liten molekyl som glykol börjar det bli svårt att tala om det som en dipol eller inte.
Hur påverkas ämnets benägenhet att reagera med andra ämnen om den är en icke dipol med polärt kovalenta bindningar, jämfört med om den är en icke dipol med opolärt kovalenta bindningar?
Om man tar koldioxid som exempel så har kolatomen oxidationstalet +4 till följd av de polära bindningarna till syreatomerna. Det innebär att det har en ganska hög positiv laddning vilket attraherar negativa laddningar. Ett exempel kan vara de fria elektronparen i vattenmolekyler. Om man bubblar ner koldioxid i vatten så kan de reagera och bilda kolsyra.
Okej, men blir ett ämne mer eller mindre reaktivt om den består av polär kovalenta bindningar istället för opolärt kovalenta bindningar? Och får ett ämne starkare bindningar om bindningarna är polärt kovalenta istället för opolärt kovalenta?
Det enklaste är nog att kolla på hur mycket energi som krävs för att bryta olika sorters bindningar, vilket är det vanligaste sättet att mäta bindningsstyrkan. Kan du se någon generell trend?
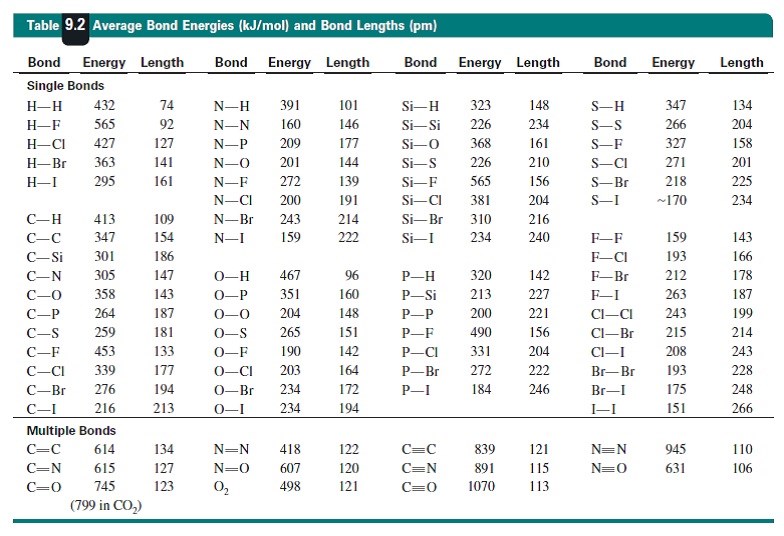
Teraeagle skrev:Det enklaste är nog att kolla på hur mycket energi som krävs för att bryta olika sorters bindningar, vilket är det vanligaste sättet att mäta bindningsstyrkan. Kan du se någon generell trend?
Jag ser att bindningarna under titeln ”multiple bonds” har högre bindningsstyrka än bindningarna under titeln ”single bonds”.
Vad för typ av bindningar är multiple bonds och vad för typ av bindningar är single bonds? Och varför har single bonds endast 1 ”sträck” mellan atomerna medan multiple bonds bindningarna har 2?
Sen så undrar jag bara om det finns en specifikt namn för den energi som krävs för att bryta bindningar?
I min förra tråd så sa du att vi kunde fortsätta på diskussionen här, så jag klipper även in den frågan:
Sen så undrar jag om en molekyl med många opolära bindningar har starkare bindningar än en molekyl med färre polära molekyler? Det brukar ju nämligen vara så att polärt kovalenta bindningar är starkare än ”rent” kovalenta bindningar, eller hur?
"Multiple bonds" är det vi kallar för dubbelbindning och trippelbindning på svenska. Det är helt enkelt flera bindningar mellan atomerna och därför krävs det också mer energi för att kunna separera atomerna.
Vill man bryta en bindning så kan man t.ex. tillföra energi i form av ljus eller värme. Det finns flera olika sätt.
Uppstår en bindning mellan atomerna för varje elektron som atomerna delar på?
Ja så kan man se det. Är det en dubbelbindning är det fyra elektroner som delas.
Okej så ett ”sträck” är betyder att det är 2 elektroner som delas?
Precis, en enkelbindning.
Okej! Uppstår enkelbindningar, dubbelbindningar, trippelbindningar o.s.v, endast hos kovalenta bindningar?
Okej, tack så mycket för hjälpen!




