Varför behövs HCl, H2O i denna reaktion?
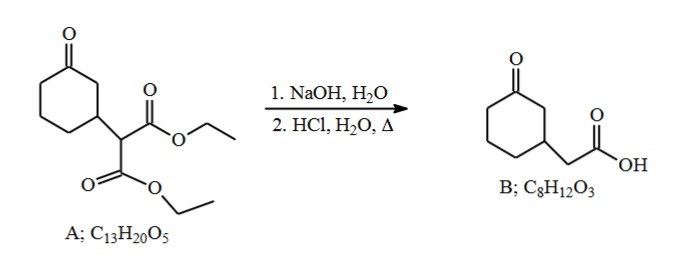
Jag tänker att det som händer när man tillsätter NaOH är att OH attackerar karbonylkolen så etoxidgrupperna lämnar molekylen. Osäker på funktionen för H2O i detta steg dock? Står det bara med som lösningsmedel? Eller finns det där för att etoxiderna ska kunna protoneras efter avfärd?
Sedan tycker jag att det ser ut som att det sker en decarboxylering. Men för det behöver man väl bara värme? Varför står det även HCl, H2O?
cellkluster skrev:
Jag tänker att det som händer när man tillsätter NaOH är att OH attackerar karbonylkolen så etoxidgrupperna lämnar molekylen. Osäker på funktionen för H2O i detta steg dock? Står det bara med som lösningsmedel? Eller finns det där för att etoxiderna ska kunna protoneras efter avfärd?
Vatten är med i bägge reaktionsstegen, så det fungerar absolut som lösningsmedel. När hydroxidjonen anfaller och ersätter etoxigruppen blir det en natriumjon över, precis som vid en förtvålningsreaktion från en fettsyraester. Det resulterande natriumetoxiden löser sig dessutom bra i vatten. pKa värdena för vatten och etanol är lika, så pH mässigt finns det ingen riktig fördel med vatten.
Sedan tycker jag att det ser ut som att det sker en decarboxylering. Men för det behöver man väl bara värme? Varför står det även HCl, H2O?
Jo värmen borde räcka, men hur ser de funktionella grupperna ut för produkten efter steg 1 om du jämför med produkten efter steg 2?
Kan syra behövas?
Jag tänker mig att produkten efter steg 1 borde se ut som startmaterialet fast med OH istället för OCH2CH3?
Nej, inte riktigt. Får du verkligen en karboxylsyragrupp (som produkten i steg 2) i närvaro av en stark bas?
Nu klickade det! Tack :)
Jag kom på en sak till, som vi inte skrev.
Dekarboxyleringar sker gärna från en beta-ketosyra eller ester. Men efter steg 1 finns det vare sig ester eller ketosyra. Men det viktiga för denna typ av dekarboxylering är att det finns en karbonylgrupp på beta-positionen, vilket det finns i produkten från steg 1.
Så den ena karboxylsyragruppen kan dekarboxyleras, med hjälp av karbonylgruppen ifrån den andra karboxylsyragruppen. Det skulle med andra ord inte gå med endast värme och syra för motsvarande monokarboxylsyra (utan att katalysator använts). Vilket så klart är praktiskt om just denna produkten önskas.
Syran är framför allt katalytisk och protonerar den lämnande karboxylsyragruppen (den förbrukas dock om produkten sedan tar upp en proton, som i bilden av produkten). När sedan denna extra proton abstraheras faller dess bindningselektronerna ner och skapar den andra dubbelbindningen till kolatomen, och samtidigt bryts enkelbindningen mellan kolatomerna, varpå en enol och koldioxid bildas. Och efter en omlagring av enolen till ketoformen fås karboxylsyragruppen i produkten, motsvarande:
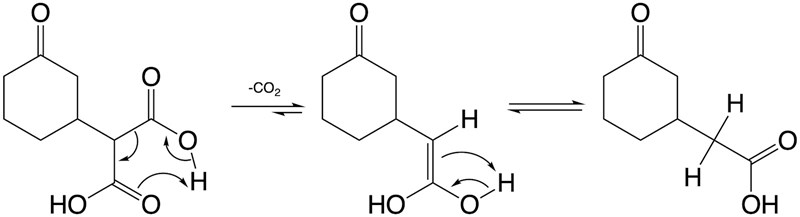
Hade karboxylsyragruppen(-erna) istället suttit direkt på ringen, meta till ketonen skulle ketonen kunna göra motsvarande. Vore det en aromatisk ring kan man nog få tillstånd dekarboxyleringar även i para, med endast en metylgrupp kvar.

