Varför har ammoniak denna strukturformel?
Hej!
Jag undrar varför ammoniak har denna strukturformeln? Blir inte väteatomerna negativt laddade i och med att de nu har 2 valenselektroner i sitt yttersta skal enligt denna bild (då 1 ”sträck” representerar 2st elektroner)?
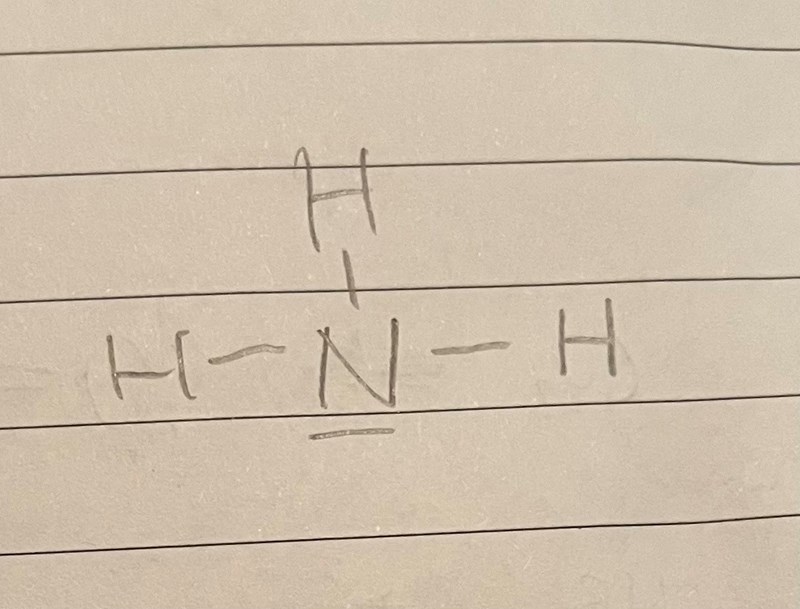
Tack på förhand!
Enligt samma logik borde ju även kvävet bli minusladdat eftersom den nu har åtta istället för fem valenselektroner.
Rätt svar är att det är kvävet som är minusladdat eftersom det är mer elektronegativt än väte. Bindningarna är polärt kovalenta vilket innebär att bindningselektronerna är förskjutna mot kväveatomen. Man ska alltså snarare se det som att väteatomerna är omgivna av noll valenselektroner, eller ja, nästan noll.
Men hur ska man tänka när man ritar en sån här strukturformel? Ska man rita ut så många valenselektroner som varje atom har? Eller hur ska man göra?
Ja, man skall rita ut alla valenselektroner på så sätt att man kan se hur de delas, precis som du har gjort.




