vätebindning eller ej?
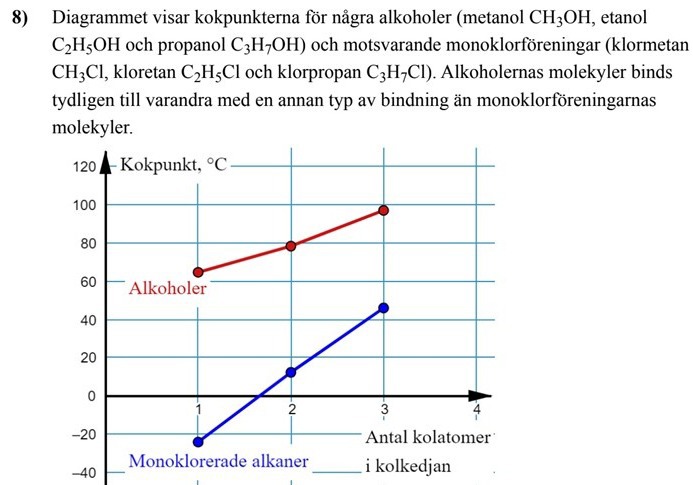
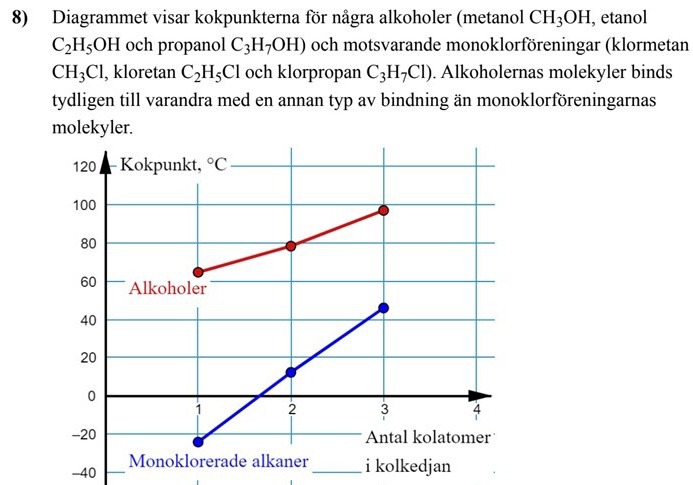
a) Vilken mellanmolekylär binding binder ihop alkoholerna i diagrammet?
ag har väldigt många frågor kring denna uppgift, så det här kanske blir lite förvirrande.
Kan det för det första ens vara en mellanmolekylär(intermolekylär) bindning? Metanol exempelvis, räknas som en molekyl. Då borde väl det vara en intramolekylär bindning som binder ihop den istället? Eller har jag missförstått frågan, handlar det om hur de olika alkoholerna binder sig till varandra, t.ex metanol och etanol? Det känns osannolikt eftersom molekylerna är neutralt laddade, varför skulle de då vilja reagera med varandra?
Men om vi nu antar att frågan ställdes på fel sätt och att man ser på bindningen som intermolekylär, så står det i facit att det är en vätebindning.
Jag har lärt mig av min lärare att reglerna för att en vätebindning mellan två molekyler ska uppstå är att en molekyl måste innehåller N, O eller F. Den andra molekylen måste innehålla ett H som inom sin molekyl binder till N, O eller F.
Metanol ( CH3OH) är uppbyggt på det här sättet:

Hur skulle då en vätebindning kunna uppstå enligt de ovanstående reglerna. Det går väl inte?
ankan01 skrev:
a) Vilken mellanmolekylär binding binder ihop alkoholerna i diagrammet?
ag har väldigt många frågor kring denna uppgift, så det här kanske blir lite förvirrande.
Kan det för det första ens vara en mellanmolekylär(intermolekylär) bindning?
Ja, det finns flera olika intermolekylära bindningar som det kan vara.
Metanol exempelvis, räknas som en molekyl. Då borde väl det vara en intramolekylär bindning som binder ihop den istället?
Det finns intramolekylära bindningar i alla molekyler, annars skulle atomerna inte binda till varandra och simma runt som grundämnen.
Eller har jag missförstått frågan, handlar det om hur de olika alkoholerna binder sig till varandra, t.ex metanol och etanol? Det känns osannolikt eftersom molekylerna är neutralt laddade, varför skulle de då vilja reagera med varandra?
Ja det har med bindningar mellan de olika molekylerna, men varje mätpunkt/prick är för en enskild molekyl, t.ex. etanol kokar vid ca 79°C. Och metanol vid 65°C. Trenden för kokpunkterna illustreras med linjen.
När två ämnen reagerar och bildar en ny kovalent bindning, då uppstår en intramolekylär bindning. Och detta skiljer sig ifrån de intermolekylära bindningar som kan uppstå mellan två molekyler som kommer nära varandra, t.ex. Van der Waals bindningar.
Men om vi nu antar att frågan ställdes på fel sätt och att man ser på bindningen som intermolekylär, så står det i facit att det är en vätebindning.
Jag har lärt mig av min lärare att reglerna för att en vätebindning mellan två molekyler ska uppstå är att en molekyl måste innehåller N, O eller F. Den andra molekylen måste innehålla ett H som inom sin molekyl binder till N, O eller F.
Metanol ( CH3OH) är uppbyggt på det här sättet:
Hur skulle då en vätebindning kunna uppstå enligt de ovanstående reglerna. Det går väl inte?
Tänk dig att du har två molekyler av metanol, som skall försöka skapa en vätebindning mellan sig, går det?
Jahaaaa
Missförstod frågan först, men jag förstår nu. Vätebindningar kan uppstå mellan metanolmolekylerna för att de uppfyller kraven. En metanmolekyl som har H bundet till O skapar en vätebindning till en annan som är innehåller O.
Tack för ditt svar!
Precis!
För all del, kul att det hjälpte!