Vattnets specifika värmekapacitet
I en laboration skulle vi försöka bestämma specifika värmekapaciteten för vatten genom att mäta upp en mängd vatten och is och värma blandningen med en doppvärmare till en viss temperatur.
mföre = 0,2645 kg
Tföre = 0°C
mefter = 0,2605 kg
Tefter = 87°C
p = 250 W
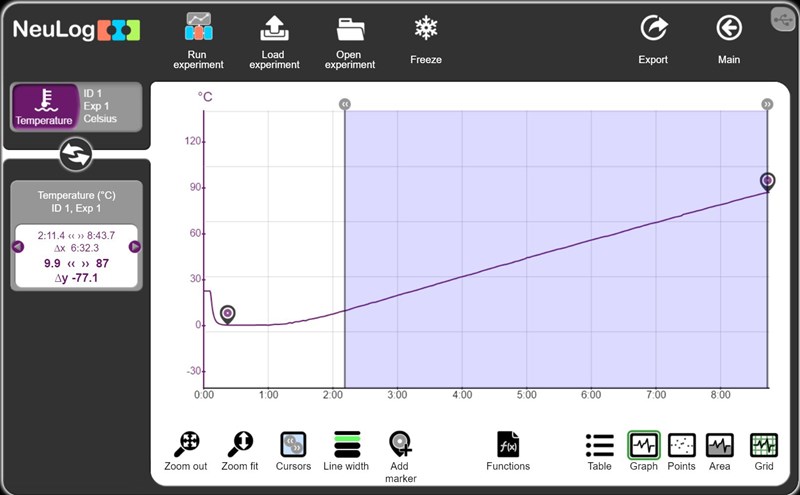
Vi använde ett program som kallas NeuLog som gav oss mätvärden för temperatur och tid, om man kollar till vänster om bilden ser man värdena som jag räknade med (värdena gäller det som är markerat med blått på grafen).
Det jag har räknat är:
E = p * t = 250 W * 392,3 s = 98075 J
c = E/(m * deltaT) = 98075/(0,2645 * 77,1) = 4809 J/(kg * K)
Specifika värmekapaciteten för vatten är 4180 J/(kg * K) så det känns ganska orimligt att det blev så stor skillnad, har jag gjort något fel?
Tack för svar!
Is behöver mycket energi för att smälta. Hur mycket is var det i blandningen?
Rörde ni om ordentligt, så att all is kunde smälta innan vattnet blev varmare än 0 oC? Grafen ser ut som om det inte var så, eftersom temperaturen ligger över 0 hela vägen.
Smaragdalena skrev:Rörde ni om ordentligt, så att all is kunde smälta innan vattnet blev varmare än 0 oC? Grafen ser ut som om det inte var så, eftersom temperaturen ligger över 0 hela vägen.
Ja vi rörde om hela tiden med termometern, nu när jag kollade igen så var den lägsta temperaturen 0,4 grader.
Laguna skrev:Is behöver mycket energi för att smälta. Hur mycket is var det i blandningen?
Vi mätte inte mängden is, utan läraren sa att vi skulle blanda vatten och is och sedan använda doppvärmaren när blandningen var nollgradig.



