Vid vilka av alternativen sker en redoxreaktion?
Jag skulle behöva hjälp att förstå vid vilka av dessa det sker en reaktion och hur reaktionsformeln då ser ut. Jag förstår att vissa reaktioner inte kommer ske pga att ämnen redan är reducerade/oxiderade men hur vet man vilka det är?
a. Zn (s) + CuCl2 (aq)
b. Ag (s) + ZnSo4 (aq)
c. Cl2 (s) + 2NaI (aq)
d. Sn (s) + MgCl2 (aq)
e. Br2 (s) + 2LiF (aq)
Hej,
Du måste använda dig av den elektrokemiska spännigsserien nedan:
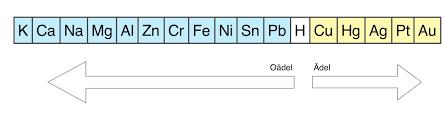
Läs här för information om redoxreaktioner och varför oxidation sker: https://ehinger.nu/undervisning/kurser/kemi-1/lektioner/periodiska-systemet/redoxreaktioner.html
Återkom om du har fler frågor.
Tillägg: 29 apr 2024 18:39
Välkommen till Pluggakuten!
Tack!
Tänker på t.ex. sista: Br2 (s) + 2LiF (aq)
Eftersom de inte är med i spänningsserien hur vet jag då hur de reagerar? Vilka ämnen är det som reduceras och oxideras?
Det som skulle kunna hända är att varje brom tar en elektron från en fluoridjonen, så att det bildas 2 Br- och F2 istället. Kommer detta hända?
Smaragdalena skrev:Det som skulle kunna hända är att varje brom tar en elektron från en fluoridjonen, så att det bildas 2 Br- och F2 istället. Kommer detta hända?
Jag antar nej eftersom flouridjonen har högre elektronegativitet? Så ingen reaktion sker?
Jag antar nej eftersom flouridjonen har högre elektronegativitet? Så ingen reaktion sker?
Helt korrekt.


