Vilka reaktioner kan bli en redoxreaktion
Hej, jag förstår inte hur jag ska tänka på den här uppgiften i kapitlet halogenernas kemi. Metaller är reduktionsmedel och där kan joner inte avge elektroner till atomer, vilket är hur man får reda på om en reaktion finns eller inte. Men Jag har inte lärt mig några regler när det kommer till halogener.
I vilka nedanstående reaktionsblandningar kommer det att ske en redoxreaktion? Skriv balanserade oxidations- reduktions och redoxreaktioner för de reaktionerna.
Halogener är oxidationsmedel. En halogen kan oxidera halogenidjoner som är under dem i periodiska systemet. Kommer du vidare härifrån?
Smaragdalena skrev:Halogener är oxidationsmedel. En halogen kan oxidera halogenidjoner som är under dem i periodiska systemet. Kommer du vidare härifrån?
Då är det som med metaller. Exempelvis i b är båda ämnena atomer, hur gör man då?
Då är det som med metaller.
Vad är det som är "som med metaller"?
Exempelvis i b är båda ämnena atomer, hur gör man då?
I b-uppgiften har du reaktionen mellan en metall i fast form och klorgas, en icke-metall som består av tvåatomiga molekyler. När en metall och en icke-metall reagerar med varandra bildas det ett .....
Vi lärde oss att att en jon inte kan ge en atom en elektron. Dock kan en atom ge bort en elektron. Detta fungerar ju inte i denna sitation för de båda är atomer.
Tydligen förstår jag fortfarande inte eftersom jag just fick fel på uppgiften igen :(
Hejsan266 skrev:Vi lärde oss att att en jon inte kan ge en atom en elektron. Dock kan en atom ge bort en elektron. Detta fungerar ju inte i denna sitation för de båda är atomer.
Det du skriver stämmer i mänga situationer, men inte när en halogen oxiderar en halogenidjon.
Tydligen förstår jag fortfarande inte eftersom jag just fick fel på uppgiften igen :(
Vad skrev du på uppgiften?
Jag fick b och c som båda är fel.
Svarade du bara b och c och inga andra?
c är en reaktion som inte kommer att ske, däremot skulle F2 + 2 Br- => 2 F- + Br2. Det skulle ha varit en redoxreaktion.
Jag svarade d också
Dock förstår jag inte riktigt varför c d e inte är redox.
c är en reaktion som inte kommer att ske, lika lite som koldioxid och vatten kan bli till bensin och syrgas.
Samma sak med d, båda ämnena är mer stabila som de är
Det händer ingenting i e heller - ingen av molekylerna "vill" dra till sig elektroner tillräckligt mycket för att kunna "göra sönder" den andra molekylen. Om det hade varit klorgas och bromidjoner skulle det ha skett en reaktion.
Hur vet jag vilka ämnen som vill reagera med varandra och vilka som inte vill det? Finns det något sätt att få reda på det tex genom formelboken?
Normalpotentialtabellen.
Är det samma sak som standardpotential? För om man kollar på den för c ligger F längre ner är Br, då borde väl Br kunna oxideras och F reduceras?
Jag tänkte på t ex den här tabellen, men i just den här finns inte reaktionen 2 F- => F2 + 2 e- med. Den borde ha stått väldigt högt upp. De reaktioner som står högt upp "vill" väldigt gärna gå åt vänster, de som är långt ner "vill" gå åt höger. Här är alla reaktioner skrivna som oxidationer.
I den här tabellen har man skrivit allting som reduktioner istället för oxidationer. Då hamnar fluor nästan allra längst ner istället.
Kan du lägga in en bild av din tabell?
Smaragdalena skrev:Jag tänkte på t ex den här tabellen, men i just den här finns inte reaktionen 2 F- => F2 + 2 e- med. Den borde ha stått väldigt högt upp. De reaktioner som står högt upp "vill" väldigt gärna gå åt vänster, de som är långt ner "vill" gå åt höger. Här är alla reaktioner skrivna som oxidationer.
I den här tabellen har man skrivit allting som reduktioner istället för oxidationer. Då hamnar fluor nästan allra längst ner istället.
Kan du lägga in en bild av din tabell?
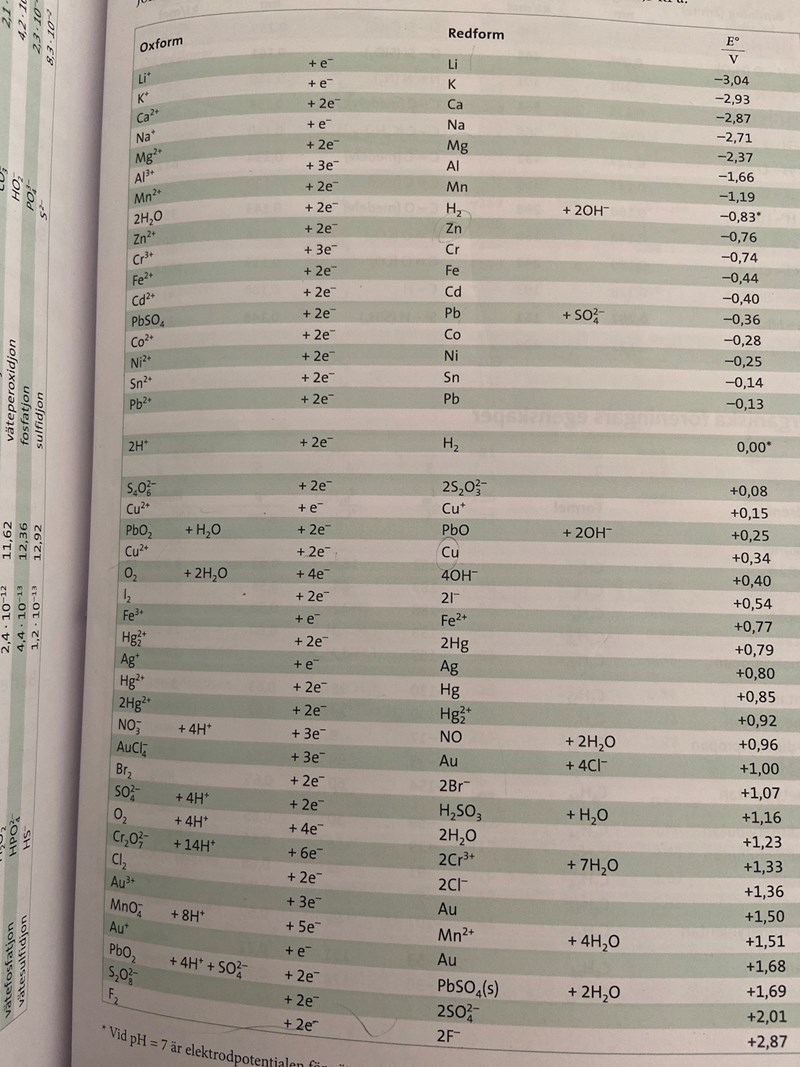 Vad menar du med att de vill gå åt vänster och höger? Vänster som att de ämnena vill oxideras?
Vad menar du med att de vill gå åt vänster och höger? Vänster som att de ämnena vill oxideras?
Du vet säkert att guld (Au) är en ädel metall, d v s guld "vill" vara i metallform, ine i jonform. I din tabell finns guld långt ner, d v s de reaktiooner som står långt ner "vill" gärna låta reaktionen gå åt höger, medan de som står högst upp "vill" att reaktionerna går åt vänster så att det bildas joner av t ex Na och K.
Br och F ligger båda långt ner varför vill de inte reagera?
Jag kanske förstår nu. I c kommer båda ämnena att reduceras.
Höger är åt det här hållet: =>
F2 ligger nedanför Br2, så den tendens som F2 har att reagera åt höger, alltså F2 + 2 e- => 2 F- är starkare än broms tendens att reagera åt höger.
Om man blandar F2 och Br- så kommer det att blidas F- och Br2 (jag bryr mig inte om att balansera formlerna).
Om man blandar F2 och Br2 så kommer det inte att hända nånting.
Om man blandar F- och Br2 så kommer det inte att hända nånting.
Om man blandar F- och Br- så kommer det inte att hända nånting.
Så egentligen handlar det om att båda vill reagera åt höger men bara en kan göra det. Eftersom F är starkare kommer den att göra det medan brom inte kommer ändras eftersom bara en kan reduceras.
Ja, fluor är bättre på att dra til sig elektroner än vad något annat ämne är på att hålla emot. Fluor kan t o m reagera med de tyngre ädelgaserna.
Så slutsatsen är att det måste finnas ett ämne från den övre delen och en från den lägre för att en redox reaktion ska kunna ske?
Om vi använder din tabell: Det måste finnas ett ämne som är "där nere till höger" och ett ämne som är "där uppe till vänster" jämfört med varandra för att det skall kunna ske en reaktion.


